文献
文献解读 | 油莎草乙酰化多糖的化学性质、抗氧化和免疫调节活性

【背景】
油莎草(学名:Cyperus esculentus L.)是莎[suō]草科莎草属植物。它含有许多成分,包括淀粉、蛋白质、脂肪、生物碱、酚类和类黄酮等,已被广泛应用于食品加工、生物医药和生物燃料开发等领域。文献也证实了其保护胃肠道、降血糖等特性。
乙酰化、磺化、羧甲基化和磷酸化常被用于修饰多糖结构,某些官能团的引入改变了分子量和其他结构特征,从而影响了生物功能特性。其中乙酰化可拉伸多糖分支,改变多糖链的空间排列,使羟基暴露,从而改变水溶性和疏水性。然而,改性对油莎草结构和性质的影响尚不清楚。
本文研究了乙酰化对油莎草的结构特征、理化性质、热稳定性、抗氧化和免疫调节活性的影响。

【样本类型】
油莎草多糖
【技术方法】
可溶性糖检测,总蛋白含量测定,还原糖检测,乙醛酸检测,紫外光谱扫描、红外光谱扫描、热重、扫描电镜、甲基化、核磁扫描、抗氧化活性检测(DPPH自由基清除活性测定、羟自由基清除活性测定、ABTS自由基清除活性测定、铁还原抗氧化能力测定、超氧阴离子清除活性测定),细胞实验:抗炎能力测定、RAW264.7细胞损伤修复能力、ROS分泌促进能力等。
【研究结果】
1、 乙酰化对油莎草多糖(CEP)的化学成分影响
乙酰化油莎草多糖(ACEP)的总糖、蛋白质、还原糖和乙醛酸水平显著低于CEP (P< 0.05)。CEP可能在改性过程中被降解,导致改性后各种化合物的量大幅减少。这些结果与之前的报告相似。
乙酰化前CEP表面粗糙,有凹陷、不均匀和粘附。乙酰化后,多糖颗粒破碎明显,呈不规则片状和短棒状,结构松散。这可能是由于CEP大多以聚集状态发生,具有较强的分子间交联,而乙酰化后分子间力降低,相关基团被释放。扫描电镜观察的多糖颗粒的表面形态是由分子间交联引起的各种分子聚集引起的,这种聚集引起构象变化,随后产生独特的形态特征。

图1 CEP(A1,500 ×;A2, 1000x;A3, 2000 x;A4,5000 × )和ACEP(A1,500 ×;A2, 1000x;A3, 2000 x;A4,5000 × )的扫描电镜图片
2、乙酰化对CEP性质的影响
CEP和ACEP的分子量分别为148和138 kDa,ACEP分子量的降低可能与多糖的降解有关(如图2A和2B)。CEP和ACEP是由葡萄糖、甘露糖、阿拉伯糖和木糖组成的杂多糖,而乙酰化并没有显著改变单糖的组成,而只是影响了比例(如图2C)。乙酰化可能导致乙酰化衍生物的分子量降低,但不会破坏多糖的主链。
CEP和ACEP在260 ~ 280 nm处有较弱的吸收峰,说明存在微量蛋白(如图2D)。与CEP的FTIR结果相比(图2E), ACEP在1720 cm-1和1247 cm-1处有很强的吸收峰。这些分别代表乙酰酯基团C-O和C-O拉伸振动,表明乙酰基修饰成功。
乙酰化对CEP热稳定性的影响该实验证明了糖的稳定性(如图2F)。CEP和ACEP有三个减重阶段:30°C - 200°C、200°C -375°C和375°C-800°C。在第二阶段,ACEP降解速度更快,表明其具有更好的热降解性能。但随着温度的升高,ACEP的重量变化相对缓慢,800℃时的剩余重量(12.46%)大于CEP(10.28%)。结果表明,乙酰化处理显著提高了CEP的热稳定性。
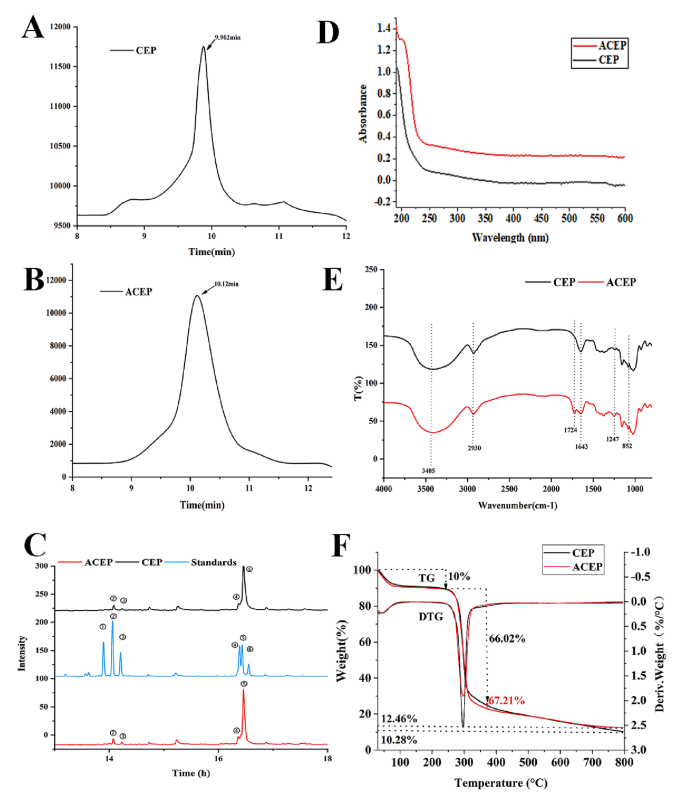
图2 (A、B) CEP和ACEP的HPLC洗脱图谱。(C)标准单糖、CEP和ACEP(-鼠李糖、-阿拉伯糖、3-木糖、④-甘露糖,-葡萄糖,-半乳糖)(D) CEP和ACEP的紫外光谱。(E) CEP和ACEP的FTIR光谱。(F) CEP和ACEP的TGA。
3、 乙酰化对CEP抗氧化能力的影响
CEP和ACEP均能有效清除DPPH自由基(如图A),且乙酰化能增强CEP的清除能力。与DPPH结果相似,乙酰化提高了CEP对ABTS自由基(如图B)、对OH自由基(如图C)、FRAP自由基(如图D) 、超氧阴离子自由基(如图E)的清除能力。综上所述,乙酰化多糖的抗氧化活性优于天然乙酰化多糖。
植物多糖清除自由基的能力受其分子结构和理化性质的影响。乙酰化修饰可以改变多糖的理化性质,从而改善其水溶性和生物活性。先前的研究表明,乙酰基可能取代多糖的C-2和/或C-3,而杂资本碳(heterocapital carbon)的氢原子活化增加了所得衍生物的供氢能力。在本研究中,ACEP的抗氧化能力超过CEP,这可能是由于引入了乙酰基以提高供氢能力。在CEP的C-2和C-6位置上取代的乙酰基可以激活端粒碳的氢原子。除了乙酰基本身外,多糖的组成和相对分子质量也与多糖的生物活性有关。低分子量多糖可以取代更多的羟基末端来消除自由基。改性后的CEP分子量降低,可能是其具有较强的自由基清除能力的原因。多项研究表明,化学修饰可以通过改变多糖的组成来提高多糖的抗氧化活性, Ara和Gal含量较高的多糖抗氧化活性更高。SEM结果也证实了ACEP的表面更加展开,这增加了其在溶液中的接触面积,有助于提高ACEP的自由基清除率,从而赋予其优越的抗氧化能力。
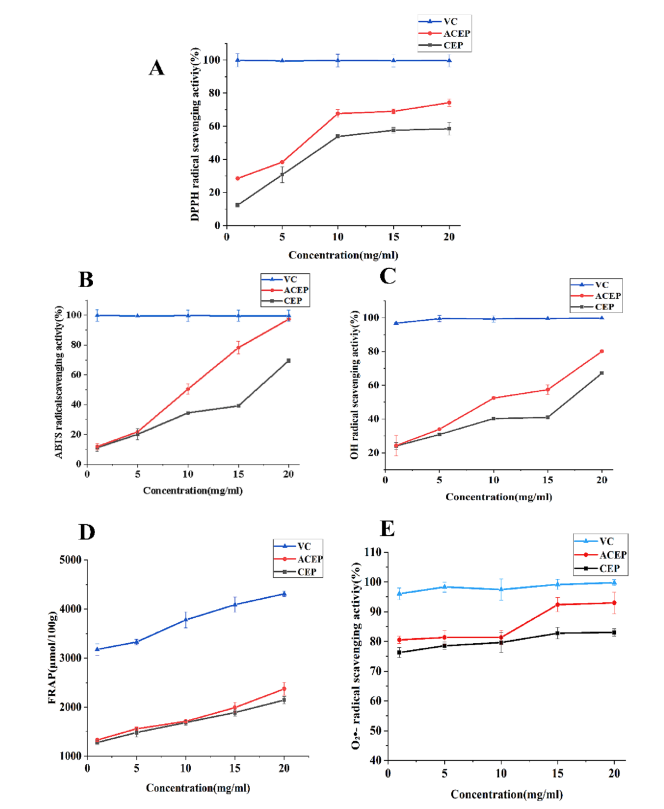
图3 (A) CEP和ACEP对DPPH自由基的清除活性。(B) CEP和ACEP对ABTS自由基的清除活性。(C) CEP和ACEP对eOH自由基的清除活性。(D) CEP和ACEP对FRAP自由基的清除活性。(E) CEP和ACEP对眼自由基的清除活性。数值表示为平均值±SD (n = 3)。
4、 乙酰化对lps诱导RAW264.7细胞CEP抗炎活性的影响
如图4A所示,CEP和ACEP对RAW 264.7细胞存活率无显著影响(P > 0.05)。
如图4B所示,与对照组相比,LPS显著降低了RAW 264.7细胞的活力(P < 0.05)。与CEP和ACEP孵育后,RAW 264.7细胞存活率从CEP的76%提高到86%,ACEP的93%,显著提高(P< 0.05)。说明CEP和ACEP均能有效减轻LPS对RAW264.7细胞的免疫损伤,且ACEP的免疫保护作用强于CEP。
细胞形态倒置显微镜下观察不同浓度CEP和ACEP(125、500和1000 μg/mL)对lps诱导的RAW 264.7细胞形态的影响。如图4C所示,对照组细胞呈圆形,生长正常。LPS处理后,细胞形态由椭圆变为伸长,大部分细胞开始漏浆。CEP或ACEP预孵育后,细胞形态有恢复趋势,随着浓度的增加,拉伸细胞数量减少,细胞形态与对照组更接近(图片空白越多表明细胞受破坏程度越严重)。结果表明,CEP和ACEP都能够修复lps诱导的RAW264.7细胞损伤,其中ACEP的修复能力更强。
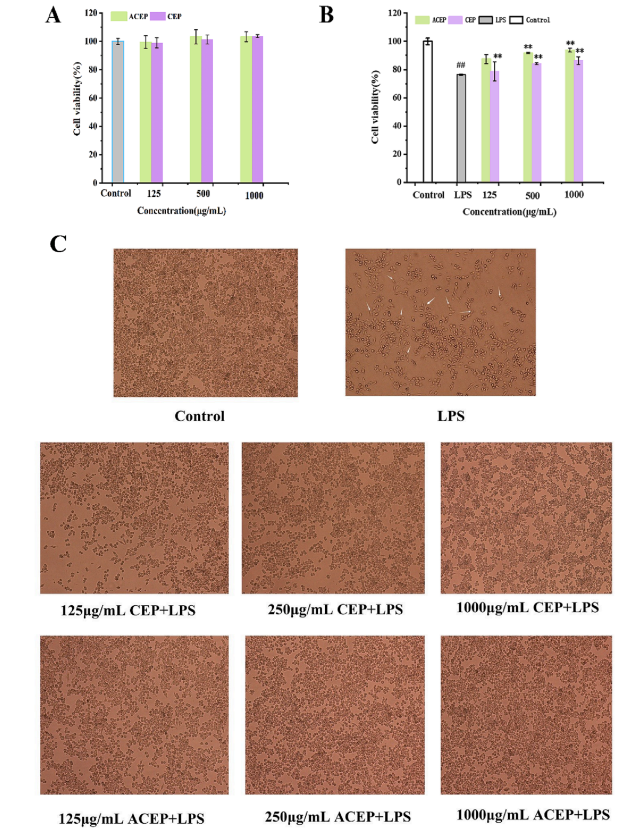
图4 (A) CEP和ACEP对RAW264.7细胞活力的影响。(B) CEP和ACEP对lps诱导的RAW264.7细胞活力的影响。(C) CEP和ACEP对lps诱导的RAW 264.7细胞形态的影响。Scar-100微米。用不同浓度的CEP或ACEP预处理细胞12 h,然后暴露于LPS (1 ug/ml)中12 h。倒置光学显微镜下观察细胞形态。数值表示为平均值±SD (n=6)。“P< 0.05”,“P< 0.001”vs对照组。与LPS组比较,P< 0.05, **P< 0.001。
ROS分泌ROS是参与正常生理代谢活动不可缺少的信号分子。巨噬细胞产生过多的ROS,刺激免疫反应(Chu et al., 2013)。如图5所示,LPS (1 μg/mL)刺激12 h后,DCFH-DA荧光强度显著增强,大部分细胞由圆形变为拉伸形态,表明ROS浓度显著升高。但不同浓度CEP和ACEP(125、500、1000 μg/mL)孵育细胞时,荧光强度呈剂量依赖性逐渐降低,且ACEP组荧光强度低于CEP组。上述结果表明,CEP和ACEP均能显著抑制lps诱导的RAW264.7细胞中ROS的产生,其中乙酰化多糖的作用更大。
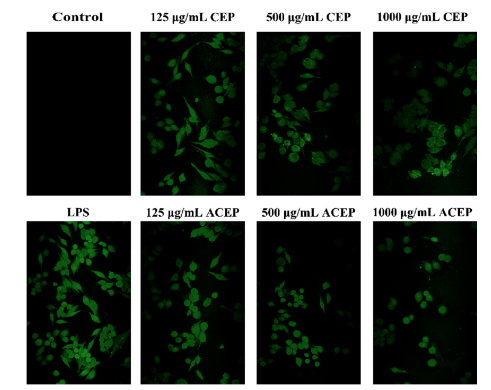
图5 CEP或ACEP抑制LPS中ROS的生成。将细胞分别用不同浓度的CED或ACEP处理12 h,然后用LPS (1 ug/mL)处理12 h,共聚焦激光扫描显微镜观察细胞的变化。细胞的荧光显微镜图像表示ROS。
【小结】
在这项研究中,作者对油莎草多糖及其乙酰化多糖的化学性质、抗氧化特性和免疫调节活性进行了研究。结果表明,CEP和ACEP是由葡萄糖、甘露糖、阿拉伯糖和木糖组成的杂多糖。CEP的主链包括a-1,4- glp残基,分支点位于a-1,6- manp残基的O-6位置。在一些葡萄糖残基的O-2和O-6位置上取代了乙酰基。乙酰化显著改善了ACEP的热稳定性,并表现出较好的抗氧化活性。CEP和ACEP均能有效缓解和修复RAW264.7细胞的免疫损伤,抑制ROS的产生。ACEP的抗炎作用也比CEP更强。综上所述,CEP和ACEP均可作为潜在的天然抗氧化剂或免疫调节剂应用于食品科学和生物学。
【往期推荐】
文献解读 | 大规模基因组和转录组学分析阐明鸡高产的遗传基础
文献解读 | 如何进行中药复方的体内机制研究,学会这个思路就够了!



