文献解读 | 四川农业大学IF 10.7!双功能ERF转录因子协同调控番茄果实细胞壁形成和赤霉素合成的分子机制

植物细胞壁是一种在发育过程中起着重要作用的动态结构,但调节细胞壁形成的机制尚不清楚。番茄果实的硬度与细胞壁组分的合成与降解过程紧密相关。尽管关于果实成熟过程中的软化调控已有较多报道,但对其转录调控机制还缺乏深入的研究。
2024年4日,四川农业大学刘明春教授课题组在Developmental Cell杂志上发表了题为“Bifunctional transcription factors SlERF.H5 and H7 activate cell wall and repress gibberellin biosynthesis genes in tomato via a conserved motif”的文章,阐明了双功能ERF转录因子协同调控果实细胞壁形成和赤霉素合成的分子机制。
番茄果实、植株
作者首先评估了SlERF.H5和SlERF.H7的表达受损是否会影响果实的硬度。观察结果表明,敲除SlERF.H5和/或SlERF.H7的H5-KO、H7-KO和h5h7果实促进了果室凝胶的形成 ,而过表达SlERF.H5或SlERF.H7导致H5-OE和H7-OE果实的局部凝胶形成较少(图1A和1B)。WT的果实显示出适当的局部空腔,其中充满了果冻样组织,甲苯胺蓝染色弱(图1B)。然而,当SlERF.H5或SlERF.H7过表达时,局部组织染色较重,失去了明显的果冻状特征,显示出厚而清晰的细胞壁(图1B)。相比之下,KO果实局部组织完全液化,导致没有甲苯胺蓝染色(图1B)。这些结果支持了SlERF.H5和SlERF.H7在果实发育早期和后期负调控局部果室凝胶形成。
此外,敲除SlERF.H5或SlERF.H7会导致果皮更薄,同时敲除SlERF.H5和SlERF.H7(h5h7)会导致果皮厚度下降更多(图 1A–1C)。H5-KO和H7-KO的果皮厚度与果实半径的比值显著降低,而在h5h7中进一步下降,H5-OE和H7-OE的果皮厚度与果实半径的比值显著增加(图1D)。此外,H5-KO、H7-KO和h5h7果实的果皮细胞层数量减少,而H5-OE或H7-OE与WT果实之间没有显著差异(图1E)。然而,WT、KO和OE果实的果皮细胞大小没有显著差异(图1F),表明KO和OE果实的果皮厚度的变化是由细胞层数量的变化引起的,但不是细胞的大小。由于凝胶液化和果皮厚度的变化会影响果实的硬度,本文研究了果实发育和成熟的十个主要阶段的果实硬度(图1G)。在10 DPA时,我们检测到KO和OE品系之间的果实硬度没有显著差异(图1G)。然而,从20 DPA开始,H5-KO和H7-KO果实的硬度明显低于WT,在h5h7更明显,而H5-OE和H7-OE果实始终保持较高的果实硬度(图1G)。值得注意的是,此时果实开始表现出结实的表型,这与果实发育早期SlERF.H5和SlERF.H7的高表达水平一致(图S1B)。在WT和OE株系中,当果实开始成熟后,果实的硬度开始下降,而KO果实的硬度从25 DPA开始下降(图1G)。这些结果表明,SlERF .H5和SlERF.H7在未成熟番茄果实发育早期具有保持高硬度的功能。
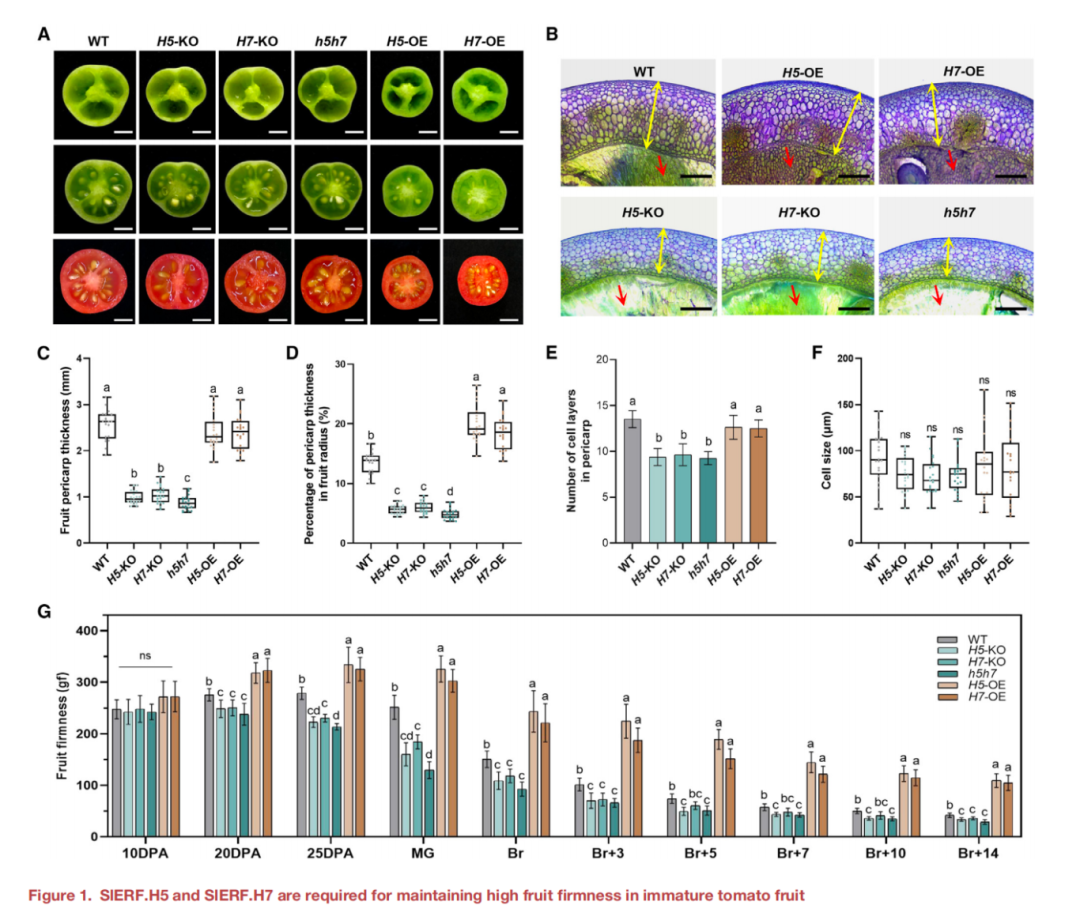
图1 SlERF. H5和 SlERF.H7是 保 持 未 成 熟 番 茄 果 实 高 硬 度 所 必 需 的
2. SlERF.H5和SlERF.H7通过调节细胞壁的形成来调节果实的硬度
与WT相比,敲除SlERF.H5或SlERF.H7导致细胞壁明显变薄,h5h7果实显示出更显著的表型(图2a和2B)。相比之下,过表达SlERF.H5或SlERF.H7会在25 DPA时产生更厚的细胞壁(图2a和2B)。在果实成熟过程中(Br+7阶段),敲除SlERF.H5或SlERF.H7可促进细胞壁降解;而在SlERF.H5-和SlERF.H7-过表达果实中,这种降解作用减弱,这可能是果实硬度增加的基础(图1F和2A)。使用刚果红专门染色细胞壁中的纤维,结果如图2C所示,细胞壁中纤维素的荧光模式与图2A中的结果一致。此外,还测定了WT、KO和OE植株果皮中的纤维素含量。与细胞壁的纤维素荧光相一致,H5-OE和H7-OE果皮纤维素含量显著升高;在25 DPA和Br+7时,H5-KO和H7-KO的纤维素含量低于WT,h5h7的含量下降大于H5-KO和H7-KO(图2D)。这些结果表明,SlERF.H5和SlERF.H7通过促进纤维素的生物合成,在番茄果实细胞壁的形成中发挥了重要作用。
三细胞连接区是降低水果硬度最重要的因素与WT相比,H5-KO、H7-KO和h5h7果实中由于细胞壁变薄而导致的三细胞连接区扩大。相比之下,H5-OE和H7- OE果实显示的三细胞连接区,细胞壁增厚(图2E)。此外,H5-KO、H7-KO和h5h7果实在双细胞连接区的细胞壁明显更薄(图2F)。相反,H5-OE或H7-OE的果实表现出夸张的厚度,双细胞连接区变化的细胞壁由多层组成(图2E和2F)。为了更好地描述细胞壁组成的变化,研究还测量了半纤维素、总果胶、原果凝集素(不溶于水,已知可提高果实硬度)和可溶性果胶(水溶性,与降低果实硬度有关)这些来自不同KO和OE系的幼果(25 DPA)和成熟果(Br+7)果实的细胞壁成分。与WT在25 DPA和Br+7下的比较,KO和OE的半纤维素和总果胶含量无显著差异(图2G和2H)。KO系的可溶性果胶含量较高,原生果胶水平较低;与野生型相比,OE系原生果胶水平升高,但可溶性果胶水平较低(图2I和2J)。综上所述,SlERF.H5和SlERF.H7通过果胶调控果实的硬度,从而调节细胞壁的形成。
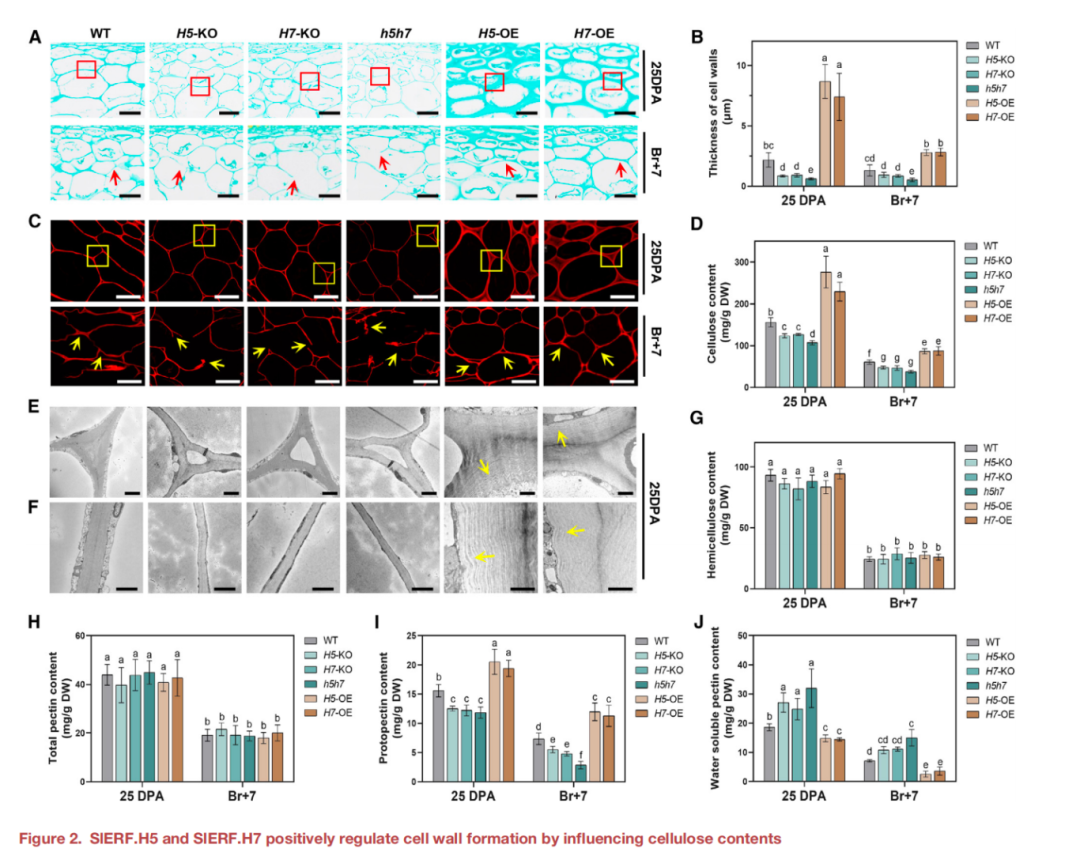
图2 SlERF.H5和SlERF.H7通过影响纤维素含量正向调节细胞壁的形成
3. SlERF.H5和SlERF.H7调控番茄果实中CESA基因的表达
为了深入了解SlERF.H5和SlERF.H7在调节果实硬度和细胞壁形成中的作用机制,本研究进行了转录组测序(RNA-seq)。图3A展示了各组间差异基因的数量。KEGG通路分析确定了多个DEGs的富集途径包括植物激素信号转导、苯丙素生物合成、糖代谢和类黄酮生物合成(图3B),表明SlERF.H5参与调控多种生理过程。H5-KO和H5-OE果实中纤维素含量改变,因此关注在RNA-seq数据中CESAs的表达水平,只有一个CESA基因Solyc01g087210在H5-KO果实中下调,而在H5-OE果实中上调(图3C)。RT-qPCR检测显示Solyc01g087210在H5-KO和H5-OE果实中的相对转录水平变化趋势与RNA-seq一致(Figu re 3D)。这些结果表明,SlERF.H5和SlERF.H7可能调节了该CESA基因的表达。
除了Solyc01g087210之外,鉴定了拟南芥中与CESAs同源的其他8个CESA基因(图3E)。通过系统发育分析,9个番茄CESAs命名为SlCESA1-9(图3E),此外,还分析确定了SlCESA1、SlCESA3和SlCESA9的表达模式与SlERF.H5和SlERF.H7高度相似(Figur e 3F)。结合这些基因SlCESA1、SlCESA3和SlCESA9在KO和OE系中的表达模式,推测SlERF.H5和SlERF.H7可能调控SlCESA1、SlCESA3和SlCESA9。
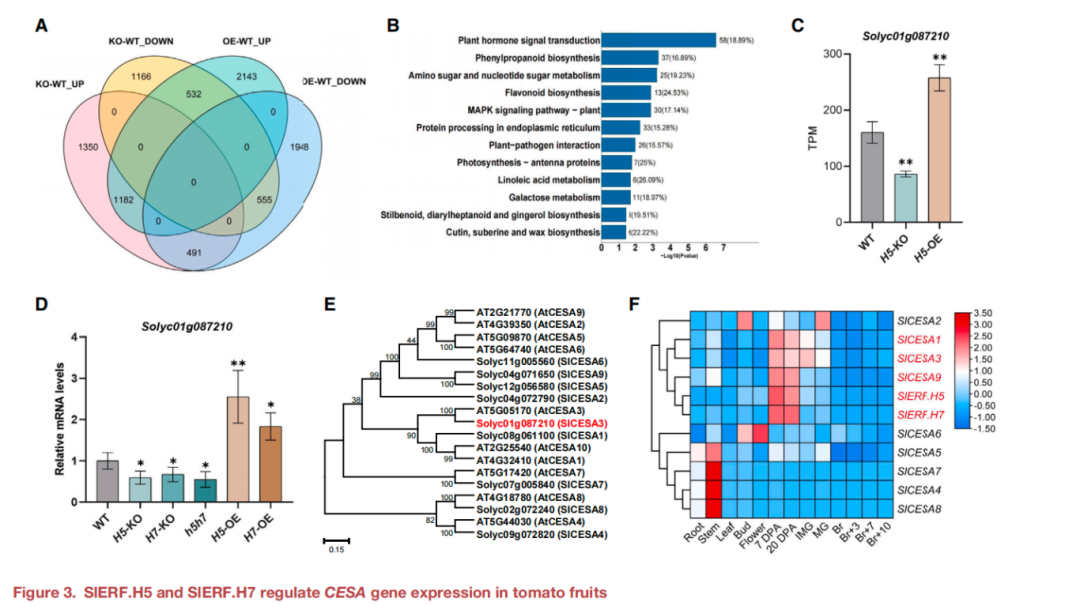
图3 SlERF.H5和SlERF.H7调控番茄果实中CESA基因的表达
为了研究SlERF.H5和SlERF.H7对SlCESA1、SlCESA3和SlCESA9的调控机制,对这三个CESAs的启动子序列进行了分析。双荧光素酶实验结果表明SlERF.H5和SlERF.H7均激活SlCESA3的转录,而不是SlCESA1和SlCESA9的转录(图4A-C)。进一步在ChIP-qPCR检测中,包含结合位点#1的SlCESA3启动子片段在35S:FLAG-SlERF.H5蛋白的免疫沉淀染色质中显著富集。重要的是,没有观察到这种对缺乏特定DRE序列的结合位点#2或#3或3‘非翻译区(3'- UTR)的富集(图4D)。基于这些数据提出SlERF.H5和SlERF.H7通过其DREs直接与SlCESA3启动子结合。此外,还进行了电泳迁移率的检测(EMSA),并证实重组纯化的SlERF.H5和SlERF.H7在体外均与含有SlCESA3启动子#1位点的DNA探针结合(图4E)。
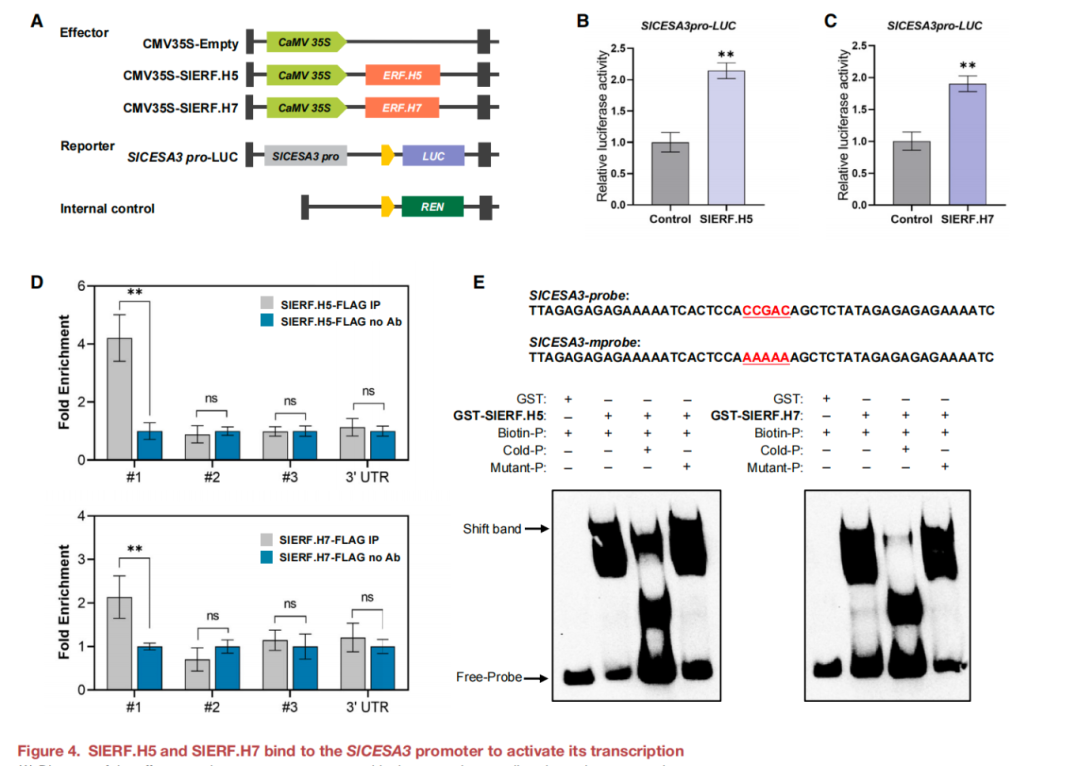
图4 SlERF.H5和SlERF.H7结合到SlCESA3启动子上,激活其转录
H5-OE和H7-OE株系均表现出矮化表型,与WT相比,植株大小显著缩小(图5A和5B),叶片更小(图5C和5D)。此外,从萌发到开花的时间,与WT和KO植株相比,H5-OE或H7-OE植株的发育时间显著延迟(图5E)。不同的SlERF.H5过表达株系的植株大小与野生型植株相比,显示出梯度变化(图5F)。为了阐明这一现象,采用RT-qPCR方法分析了3个H5- OE细胞株系叶片中SlERF.H5的相对表达水平,发现SlERF.H5的表达水平与植株大小呈负相关。
在本研究中过表达SlERF.H5或SlERF.H7可以激活SlCESA3的表达, 同时也产生了矮化的植物。推断SlERF.H5和SlERF.H7可能通过一个独立于纤维素生物合成的途径来调节植物的生长。为了调查这种可能性,在5周龄H5-OE和WT植株的叶片上进行RNA-seq检测,发现H5-OE和WT植株中有1940个上调的和2484个下调的差异表达基因(DEG)(图5J)。“KEGG”通路分析确定DEGs在多种途径中的富集,特别是单萜、二萜、三萜、五萜和SES类物质的生物合成途径受到影响(图5K),提示SlERF.H5可能参与调控萜类物质的生物合成。
所有GA生物合成相关,除2个GA2ox基因外,H5-OE中的GA基因表达下调(图5L),表明H5-OE植株中GA水平降低。为了验证这个想法, 采用液相色谱串联质谱(LC-MS/MS)法测定H5- OE植物中的激素含量。结果显示, H5-OE植物中GA1、GA3、GA4等生物活性GAs水平显著下降(图5M)。用外源生物活性GA3处理2周龄的H5-OE植株 ,外源GA处理很大程度上恢复了H5-OE植株的缩小(图5N和5O)。
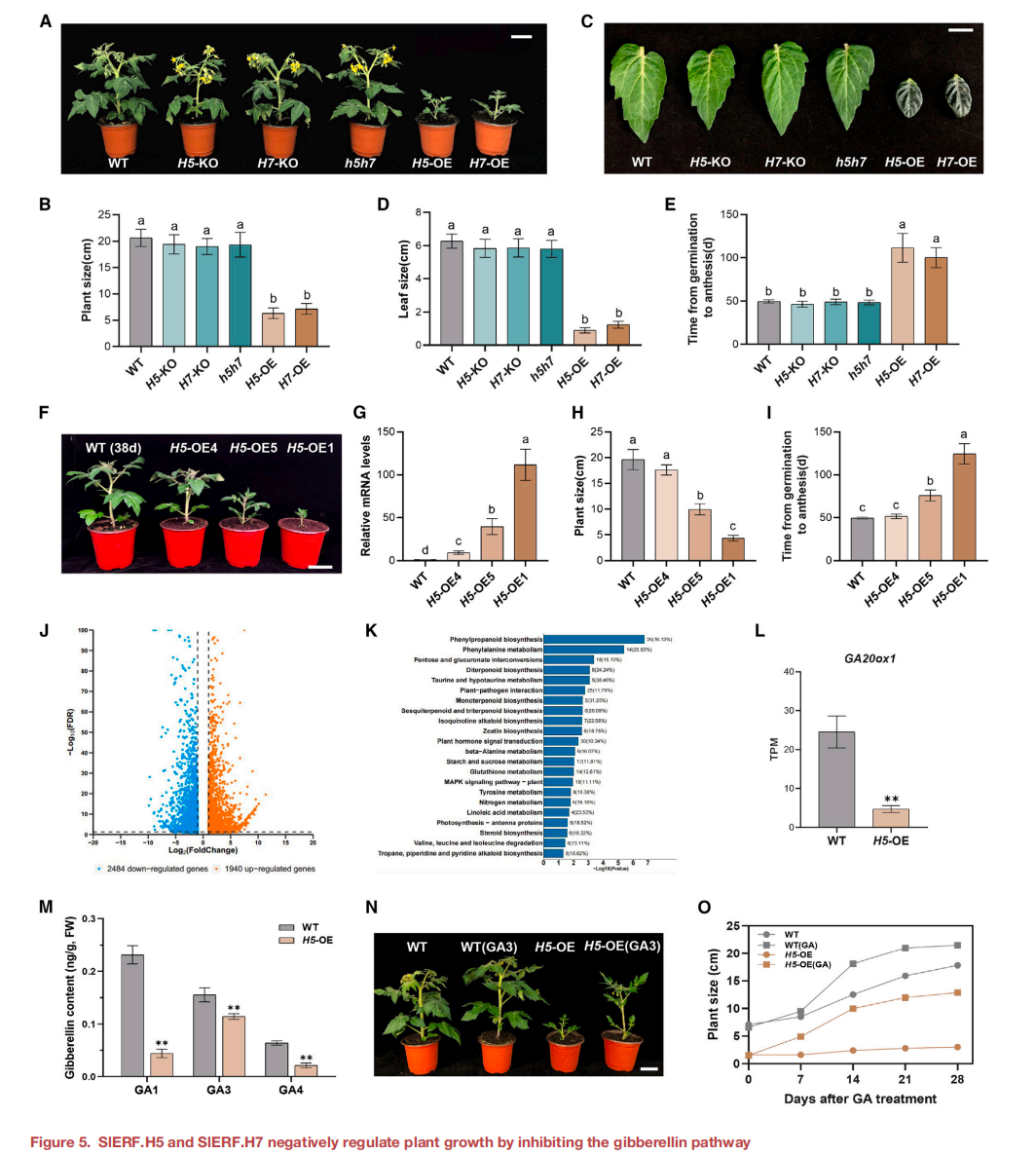
图5 SlERF.H5和SlERF.H7通过抑制赤霉素途径负调控植物生长
虽然发现SlERF.H5和SlERF.H7通过其转录激活因子功能来调节细胞壁的形成,但在OE植物中GA20ox1的表达量下调(图6A)可能意味着它们也可以作为转录抑制因子。为了研究这种可能性,检测了SlERF.H5或SlERF.H7在反激活试验中抑制VP16介导的转录能力,VP16是一种从单纯疱疹病毒蛋白衍生的强激活物(图6B)。SlERF.H5和SlERF.H7融合蛋白均抑制了VP16介导的LUC活性,表明这两种ERFs 可以作为转录阻遏因子(图6B)。还通过proGAH活化实验研究了SlERF.H5和SlERF.H7是否可以抑制GA20ox1的转录(图6C)。将35S:SlERF.H5或35S:SlERF.H7效应基因与proGA20ox1:LUC报告质粒共转染,与对照相比,显著降低了本氏梭菌中LUC的相对活性(图6C),表明SlERF.H5和SlERF.H7抑制了GA20ox1的转录。评估SlERF.H5和SlERF.H7是否直接与 GA20ox1启动子结合,利用35S:FLAG-SlERF.H5和35S:FLAG-SlERF.H7植株的叶片和抗flag抗体进行了ChIP-qPCR。含有保守DREs的GA20ox1启动子片段在SlERF.H5-FLAG和SlERF.H7-FLAG植物中免疫沉淀的染色质中富集(图6D),而缺乏特异性DREs的3'-UTR没有显著的富集(图6D)。此外,在EMSA中 ,SlERF.H5和SlERF.H7均直接与GA20ox1启动子中含有DREs的DNA探针结合(图6E)。综上所述,SlERF.H5和SlERF.H7可以抑制其靶基因GA20ox1的转录,负调控植物生长。
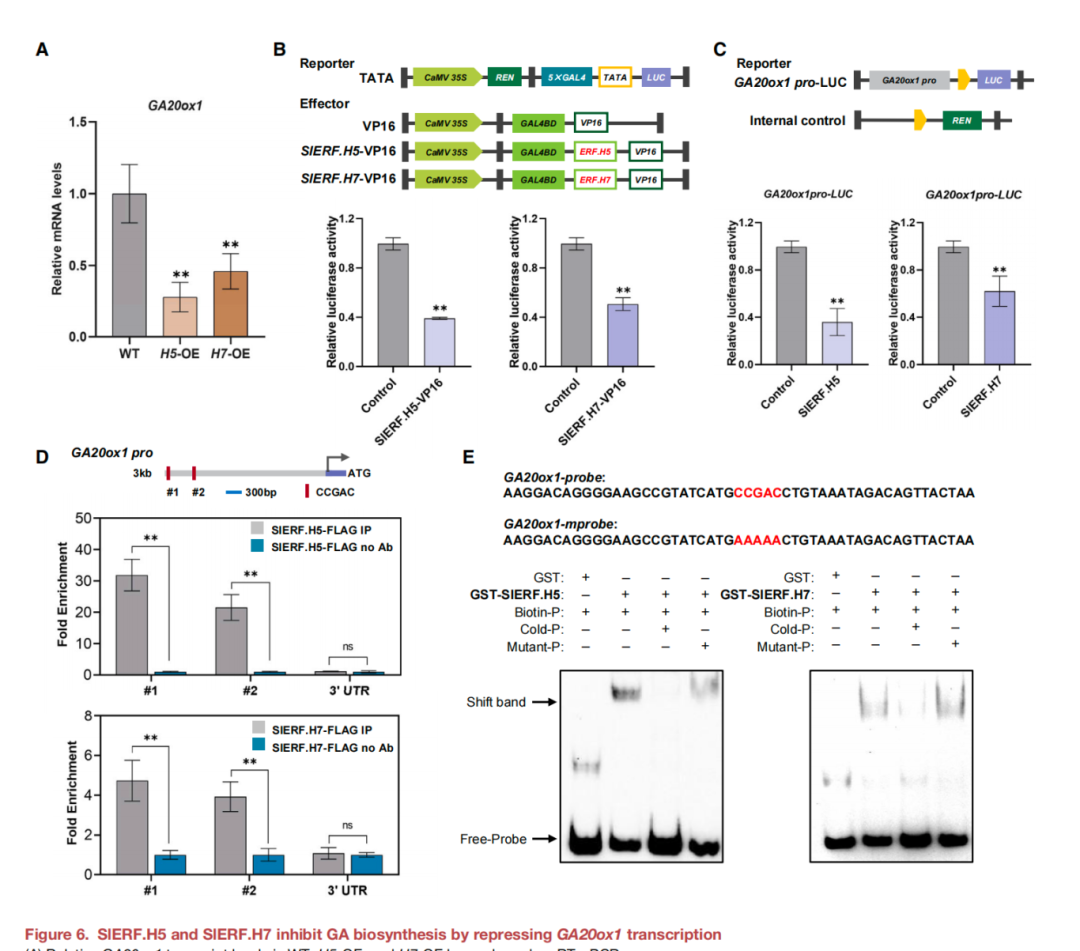
图6. SlERF.H5和SlERF.H7通过抑制GA20ox1的转录来抑制GA的生物合成
基序富集分析发现了之前未知的基序LPL,其核心序列为D(E)LPD(S)L(图7A)。为了研究LPL基序对SlERF.H5和SlERF.H7转录活性的影响,将SlERF.H5中的DLPDL序列和SlERF.H7中的ELPSL序列突变为AAAAA从而产生ERFs的突变体mERF.H5和mERF.H7(图7B)。双荧光素酶实验结果显示,与SlERF.H5和SlERF.H7对GA20ox1的转录抑制相比,用mERF.H5或mERF.H7质粒在本氏叶原生质体中转染,失去了抑制报告基因GA20ox1转录的能力(图7C),表明该基因SlERF.H5-或SlERF.H7-介导的转录抑制依赖于LPL基序。随后构建了mERF.H5过表达(mH5- OE)细胞系,H5的表达是由增强的35S启动子驱动的。mH5-OE株系中mERF.H5的转录水平是WT植株内源性SlERF.H5水平的50倍以上(图7D)。与H5-OE植株所表现出的严重矮化表型不同,mH5-OE植株的大小与WT相当(图7E和7F)。此外,mH5-OE植株的生物活性GA含量与WT没有显著差异(图7G),表明LPL基序是SlERF.H5介导抑制GA生物合成所必需的。此外,mH5-OE的细胞壁形态在25 DPA时的果实与WT果实相似(图7H和7I),细胞壁无显著差异。与野生型果实相比,mH5-OE果实的厚度(图7J)无显著变化,mH5- OE果实中的纤维素含量并没有显著增加(图7K),这表明LPL基序是SlERF.H5激活纤维素生物合成所必需的。综上所述,这些发现支持了LPL基序对SlERF.H5-和SlERF.H7介导的转录至关重要的,包括纤维素生物合成基因的激活和GA生物合成基因的抑制。

图7 SlERF.H5和SlERF.H7的功能依赖于一个保守的基序
植物细胞壁是一种在发育过程中起着重要作用的动态结构,本研究证明了两个转录体SlERF.H5和SlERF.H7以双向的方式控制细胞壁形成和番茄果实硬度。敲除SlERF.H5、SlERF.H7或这两种基因都会降低细胞壁厚度、硬度、在果实发育早期过程中的纤维素含量,特别是在双敲除系中。过表达任何一个基因都会导致更厚的细胞壁和更大的果实硬度与纤维素的升高,果实中糖含量、赤霉素含量降低。进一步发现SlERF.H5和SlERF.H7激活纤维素生物合成基因SlCESA3,但抑制赤霉素生物合成基因GA20ox1。此外,在这些ERFs中发现了一个保守的LPL基序,负责它们作为转录激活因子和抑制因子的活性,这为了解双功能转录因子如何调节不同的发育过程提供了见解。
左滑查看更多:
排版:野凌
审核:三黍生物企宣部




