客户文章 | 人参可溶性多糖GSPA-0.3的结构、活性与机制研究

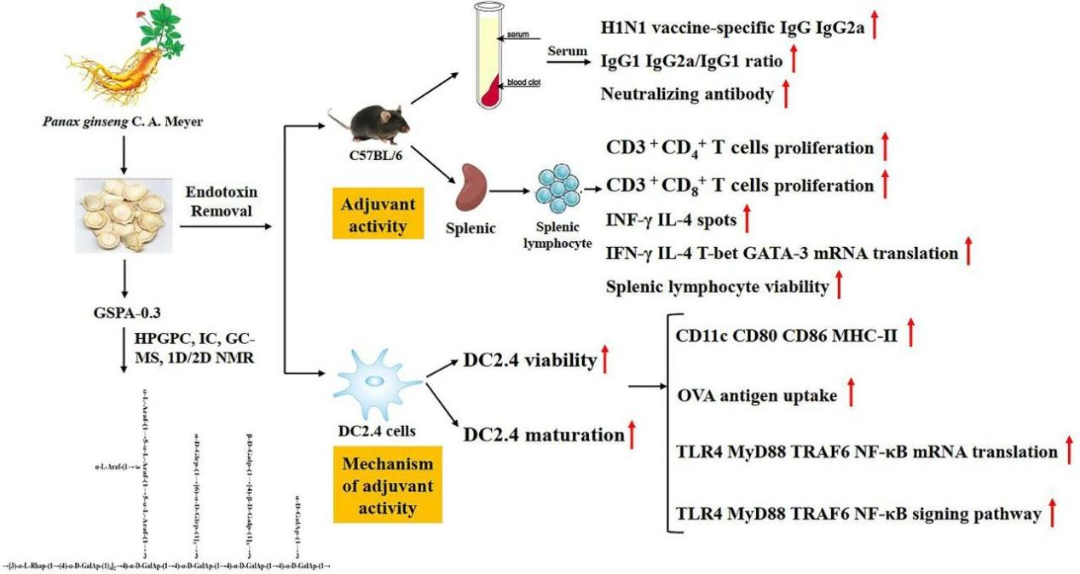
人参在中国历史上一直被用作补气药,可增强机体对非特异性损伤和疲劳的抵抗力。多糖占人参成分的 4-6%,被认为是干根中最突出的免疫增强成分之一。最近的研究报告了人参多糖的分离和特征,这些多糖具有显著的抗氧化作用和抗辐射作用。在之前的一项研究中,从人参中分离出的一种酸多糖(GSPA)能显著提高甲型 H1N1 流感疫苗免疫小鼠的中和抗体水平,其功效优于作为佐剂的明矾。
2024年2月,沈阳药科大学中药学院翟健秀\殷军教授团队在Carbohydrate Polymers发表题目为“Structural analysis of a soluble polysaccharide GSPA-0.3 from the root of Panax ginseng C. A. Meyer and its adjuvant activity with mechanism investigation”的研究论文,从培养的人参根中分离纯化了一种新的多糖(GSPA-0.3),并通过分子量、单糖组成、甲基化、核磁共振和质谱分析,阐明了GSPA-0.3的结构及其单糖组成。利用DC2.4细胞对GSPA-0.3 的 H1N1 疫苗佐剂活性和安全性进行了进一步的体外评估,同时在 H1N1免疫小鼠体内对其佐剂活性进行了评估,证实了GSPA-0.3可能通过TLR4-MyD88-NF-κb信号通路调节Th1/Th2应答,从而显著提高H1N1疫苗的疗效。

人参多糖、C57BL/6小鼠、DC2.4 细胞
分子量分析、单糖组成分析、红外光谱分析、紫外-可见光谱分析、甲基化分析、核磁共振分析、扫描电镜分析、原子力显微镜分析、刚果红检测、免疫小鼠模型、RT-PCR、ELISA、细胞实验
1. GSPA-0.3的提取与纯化
从人参中提取并纯化得到GSPA-0.3。提取过程包括热水提取、乙醇沉淀和冻干处理,随后通过离子交换柱层析和Sepharcyl S200 HR柱层析进一步纯化。GSPA-0.3的总碳水化合物含量高达91.5%,且醛酸含量占36.6%。
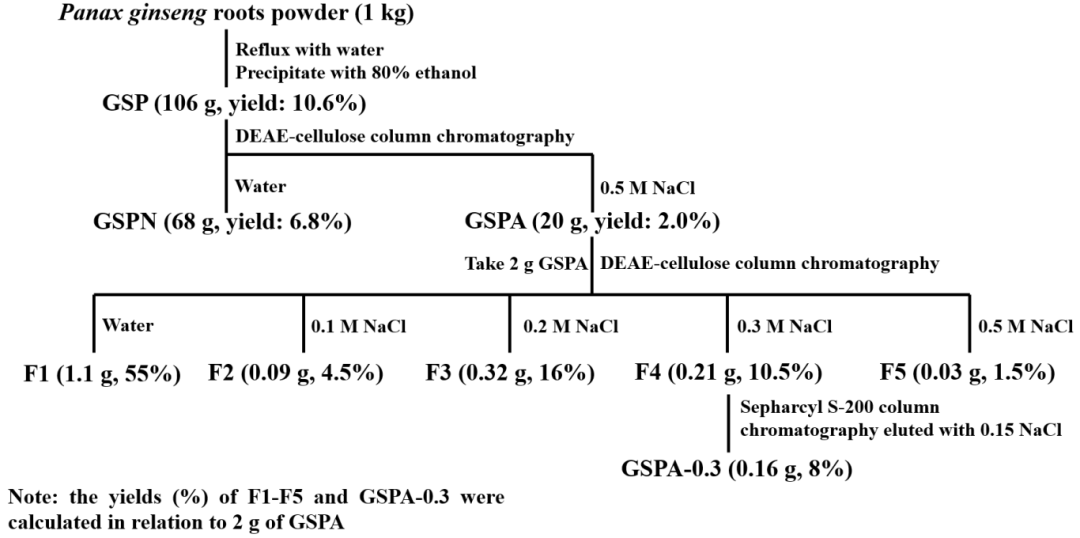
图1 GSPA-0.3纯化示意图
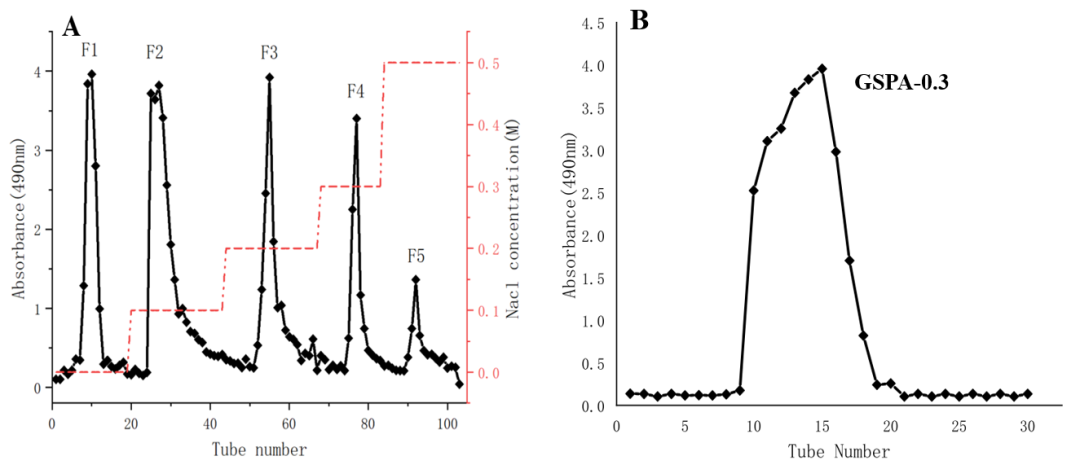
图2 从人参根中分离纯化GSPA-0.3。(A)粗多糖在DEAE-52柱层析上的洗脱剖面。(B) GSPA-0.3在Sephacryl S-200 HR柱层析上的洗脱曲线
2. GSPA-0.3的化学特性
GSPA-0.3的紫外-可见光谱分析显示,该多糖在260 nm和280 nm处没有吸收,说明其中不含蛋白质和核酸。FT-IR光谱揭示了GSPA-0.3中典型的糖类特征,包括O-H拉伸振动、C-H拉伸和弯曲振动,以及吡喃糖环的C-O弯曲振动。这些结果证实了GSPA-0.3是一种具有复杂结构的酸性多糖。
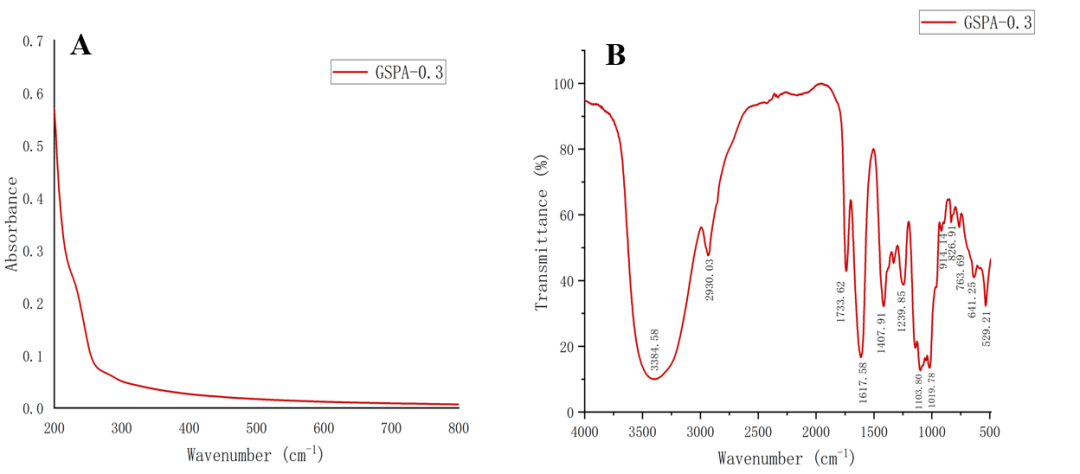
图3 GSPA-0.3的UV光谱(A)和FT-IR光谱(B)
3. 分子量和单糖组成分析
通过HPGPC和HPSECMALLS-RI分析,GSPA-0.3的相对分子量和绝对分子量分别为63,350 Da和62,722 Da,显示出较高的分子量均匀性。单糖组成分析表明,GSPA-0.3主要由半乳糖、阿拉伯糖、葡萄糖、鼠李糖和半乳糖醛酸组成,其中半乳糖醛酸的比例最高。

图4 (A) HPGPC光谱;(B) GSPA-0.3的摩尔质量分布色谱图;(C-D)标准样品和GSPA-0.3的单糖组成谱
4. 键合结构分析
采用甲基化和GC-MS分析揭示了GSPA-0.3中糖残基的键合结构,包括11种不同类型的键。其中,4-Gal(p)-UA(半乳糖醛酸的4位连接)占据最大比例,表明它是GSPA-0.3的主要骨架结构。此外,该分析还确认了GSPA-0.3中各种糖残基的相对比例,与单糖组成数据相近。
5. 核磁共振分析
通过一维和二维核磁共振分析,GSPA-0.3的结构得到了深入解析。在核磁共振波谱中,特定的化学位移(δ值)揭示了GSPA-0.3的糖残基构型和连接模式。δ 4.3-5.5 ppm范围内的1H和δ 92-110 ppm范围内的13C信号确认了α-和β-构型的存在。δ 170 ppm附近的信号则证明了糖醛酸的存在,这与之前的单糖组成分析一致。结构分析显示,GSPA-0.3的主骨架由[→3)-α-L-Rhap-(1→4)-α-D-GalpA-(1→3,4)-α-D-GalpA-(1→]的重复单元组成。此外,分支结构包括[α-L-Araf-(1→3,5)-α-L-Araf-(1→5)-α-L-Araf-(1→)]、[α-D-Glcp-(1→6)-α-D-Glcp-(1→6)-α-D-Glcp-(1→)]、[β-D-Galp-(1→4)-β-D-Galp-(1→4)-β-D-Galp-(1→)]和α-D-GalpA-(1→)单位,这些单位直接连接在主骨架的特定位置上。
表1 GSPA-0.3甲基化结果(%)
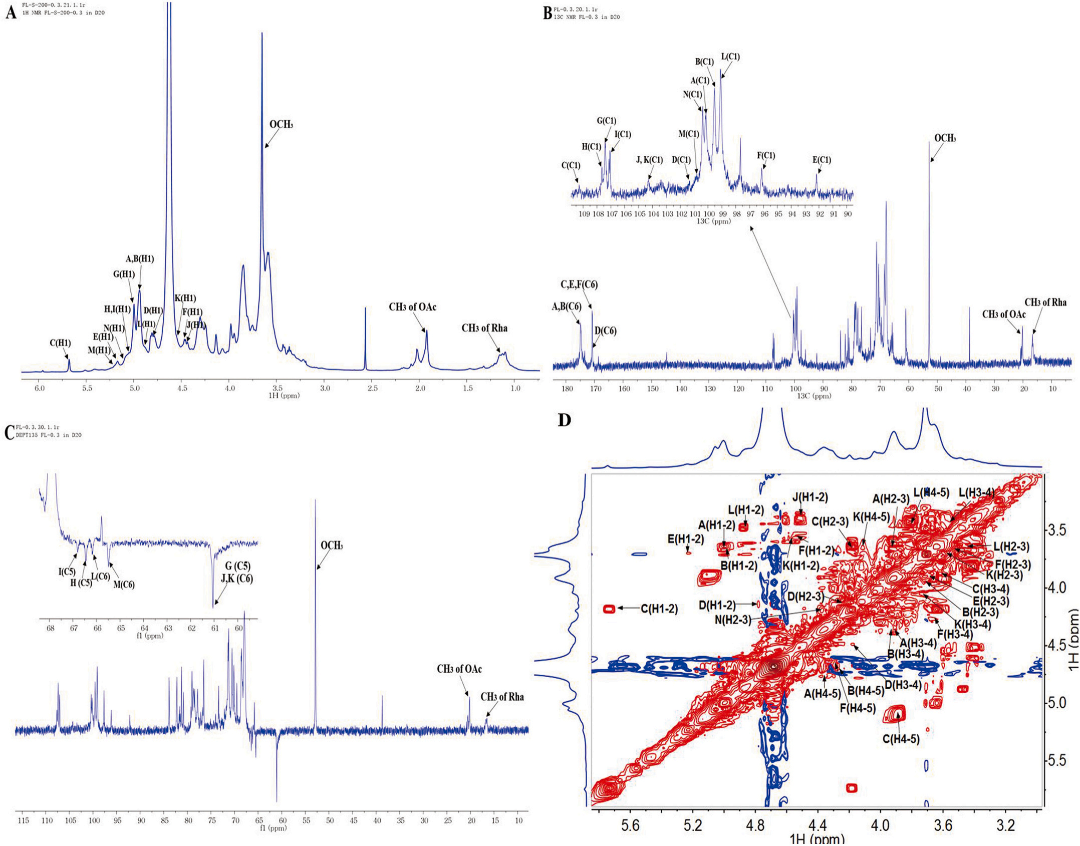
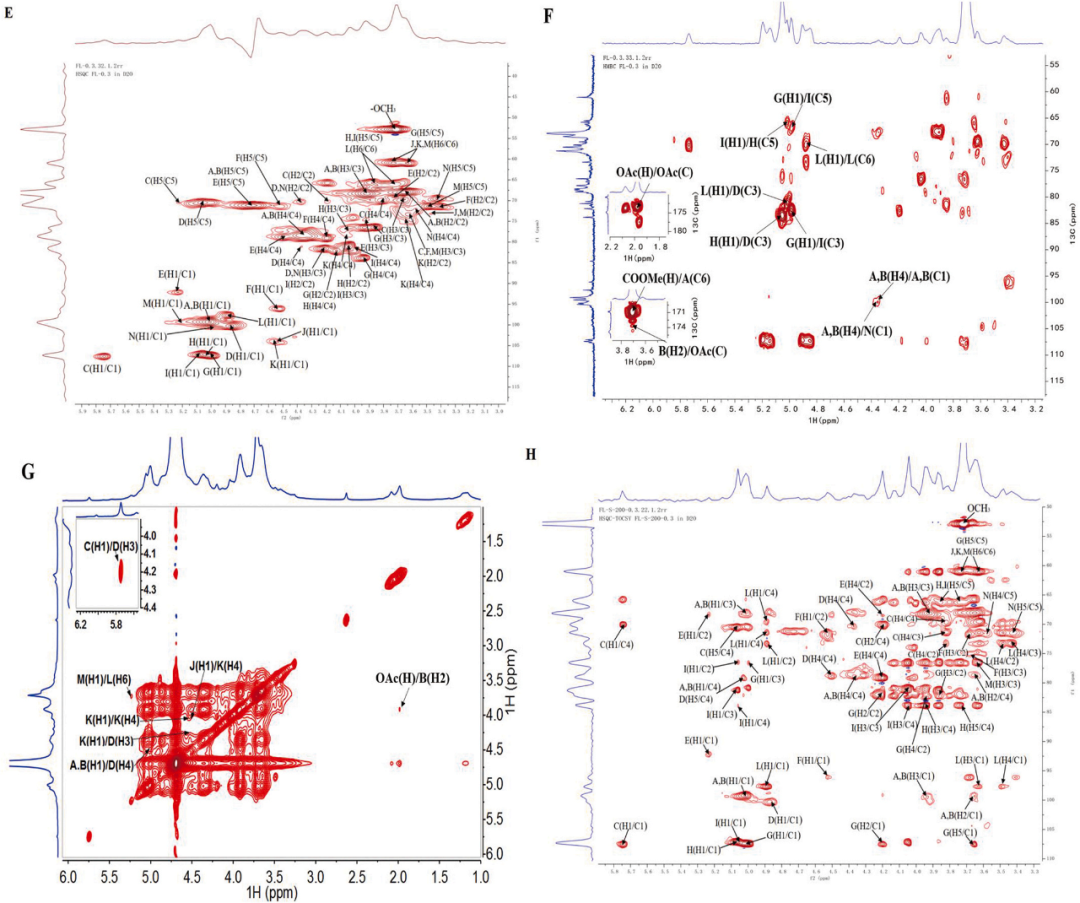
图5 GSPA-0.3的(A)1H NMR、(B)13C NMR、(C)DEPT-135、(D)COSY、(E)HSQC、(F)HMBC、(G)NOESY、(H)HSQC- TOCSY谱
表2 GSPA-0.3的化学位移
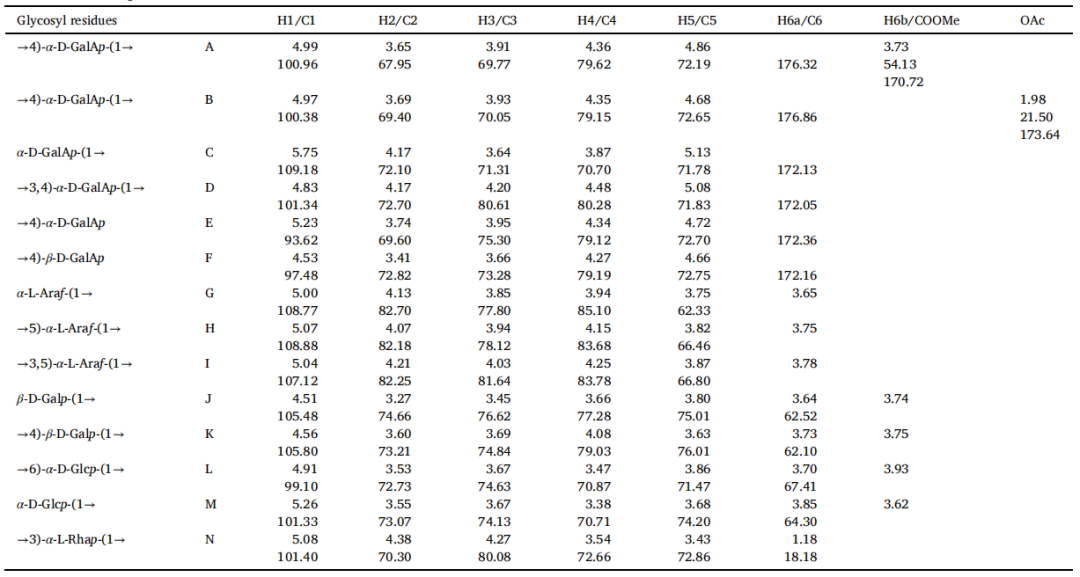
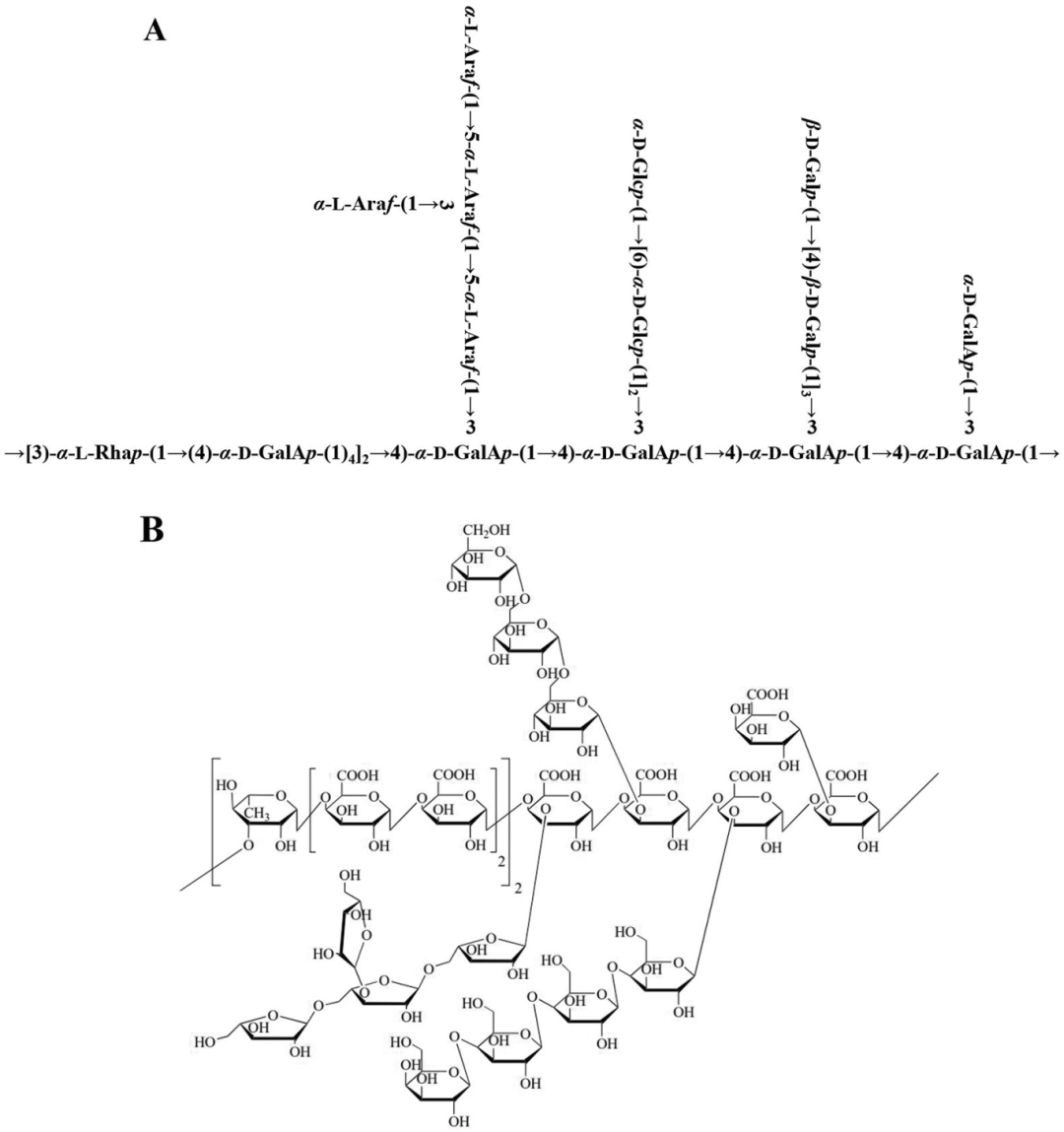
图6 (A) GSPA-0.3的结构;(B) GSPA-0.3的结构公式
6. 扫描电镜和原子力显微镜分析
GSPA-0.3通过扫描电镜(SEM)和原子力显微镜(AFM)观察,呈现出不对称的片状结构裂纹,显示其非晶结构特性。AFM图像揭示了GSPA-0.3的微观结构中存在多个岛状结构,大小在4.2 nm至6.6 nm之间。这些特征表明GSPA-0.3的聚集结构可能是由分子链的相互缠绕以及分子间和分子内氢键的相互作用形成的。
7. 三螺旋结构分析
通过刚果红法检测,GSPA-0.3在增加NaOH浓度的过程中,其刚果红多糖复合物的最大吸收波长(λmax)变化不显著,表明GSPA-0.3不存在典型的三螺旋结构。这一发现提供了关于GSPA-0.3结构特性的重要信息,对于理解其生物活性和潜在应用具有意义。
8. 热性质研究
通过热重法(TG-DTG)和差示扫描量热法(DSC)对GSPA-0.3的热性质进行了评估。在30°C至800°C的温度范围内,GSPA-0.3经历了三个显著的质量损失阶段,分别归因于水分蒸发、多糖结构解聚和有机物氧化分解。DSC分析显示,GSPA-0.3在第一次加热循环中表现出无定形性质的不稳定性,而在冷却和第二次加热循环中则显示出可能的结晶趋势。这些热性质数据为GSPA-0.3的稳定性和加工应用提供了重要参考。

图7 GSPA-0.3的SEM (A-C)和AFM (D-E)
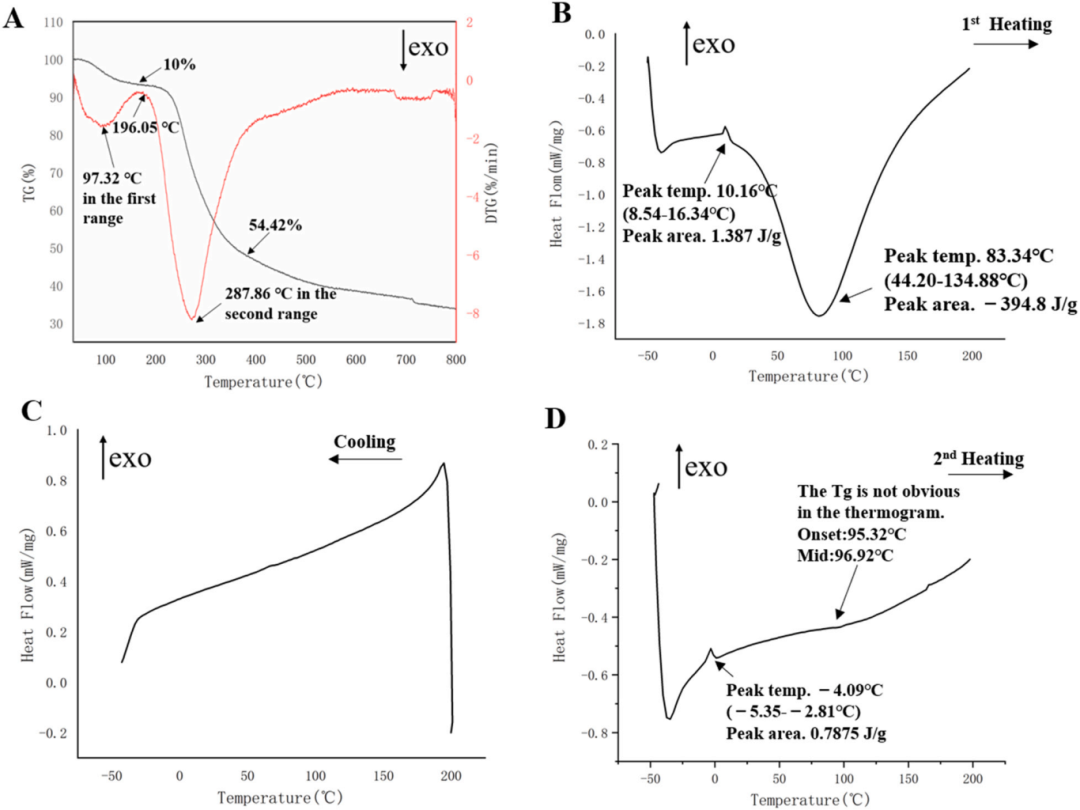
图8 (A) TG-DTG曲线,(B)第一个升温DSC曲线,(C)冷却DSC曲线,(D)第二个升温DSC曲线(升温速率10℃/min, N2环境)
9. 体内实验结果
通过CCK-8法检测,GSPA-0.3显著促进了脾细胞的活力和增殖,且这种促进作用呈剂量依赖性。与H1N1组和明矾组相比,GSPA-0.3显示出更高的促增殖活性。在免疫小鼠中,GSPA-0.3显著提高了IgG、IgG1、IgG2a水平及IgG2a/IgG1比值,表明其增强了特异性抗体水平和体液免疫反应。此外,高剂量GSPA-0.3更有效地提高了中和抗体水平。

图9 (A) GSPA-0.3对脾细胞活力的影响。(B-D) GSPA-0.3与H1N1疫苗、Con A和LPS共孵育时对小鼠脾细胞增殖的影响
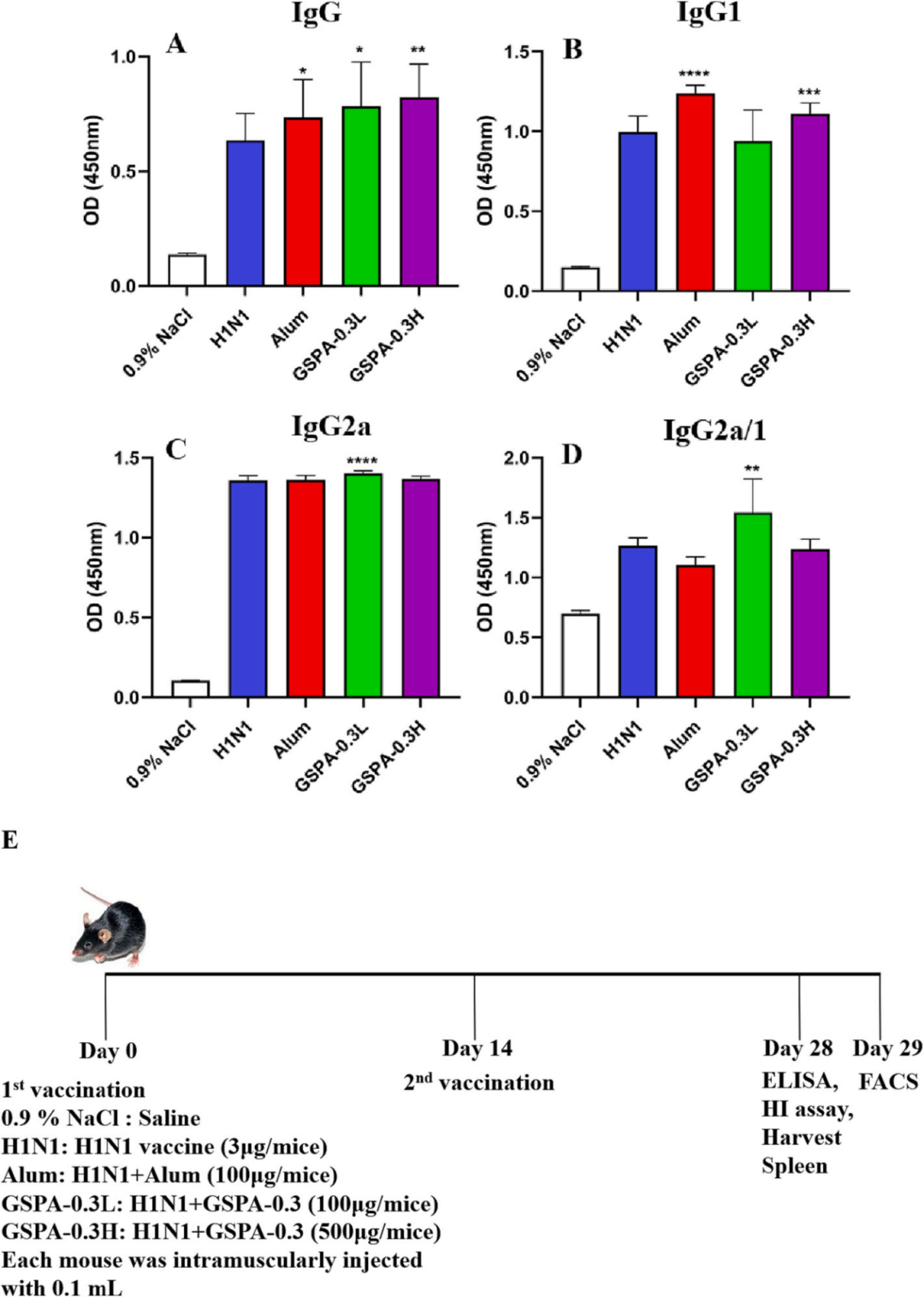
图10 GSPA-0.3对小鼠h1n1特异性抗体水平的影响
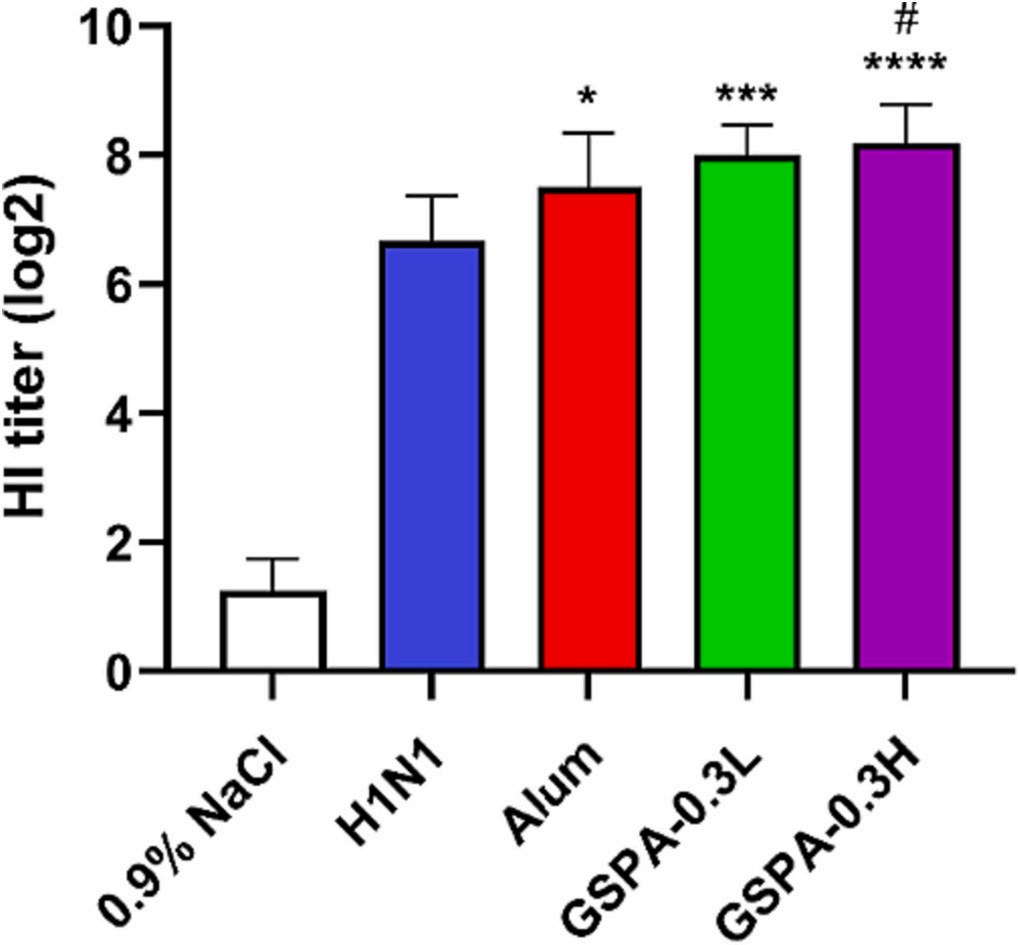
图11 小鼠h1n1特异性中和抗体水平
流式细胞术分析显示,GSPA-0.3显著提高了免疫小鼠CD3+/CD4+和CD3+/CD8+比值,表明GSPA-0.3对T细胞亚群有积极影响,且效果优于明矾佐剂。RT-PCR和ELISpot分析表明,GSPA-0.3显著提高了T-bet、GATA-3、IFN-γ和IL-4等促炎细胞因子编码基因的表达水平,促进了Th1和Th2细胞产生的细胞因子表达,呈剂量依赖性。
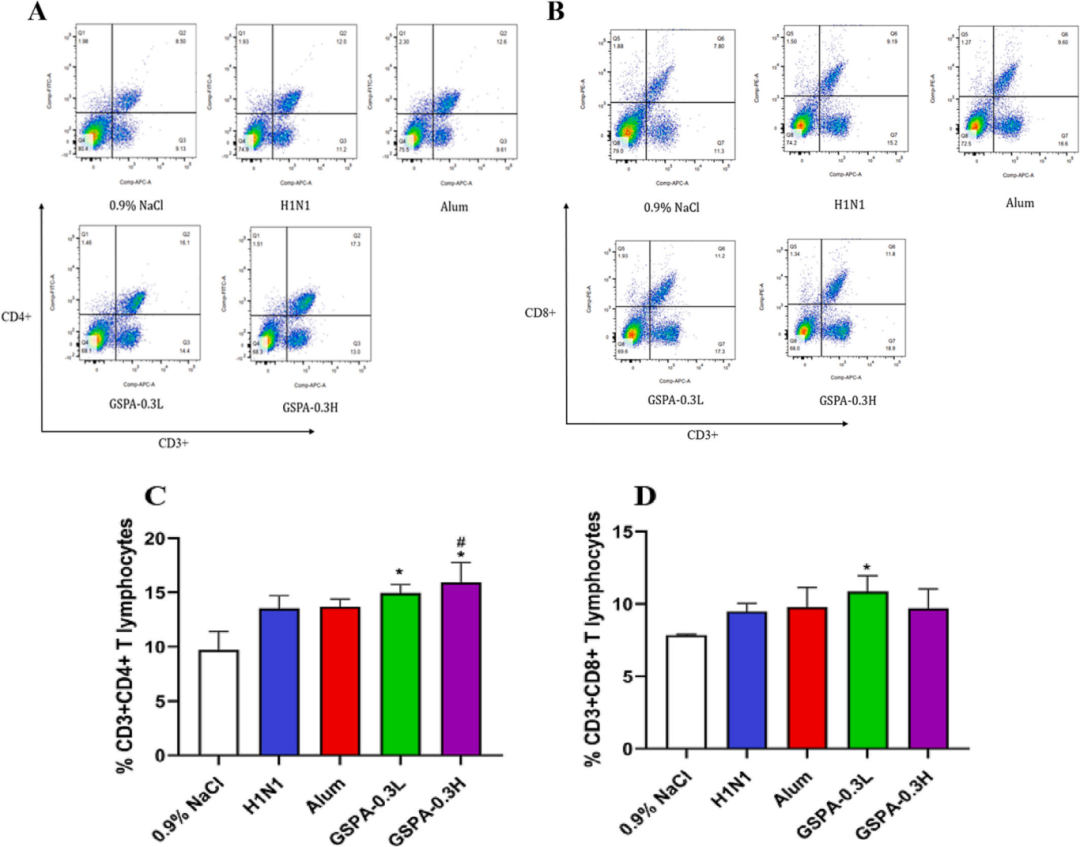
图12 取免疫小鼠脾细胞,用CD3+/CD4+/CD8+抗体染色
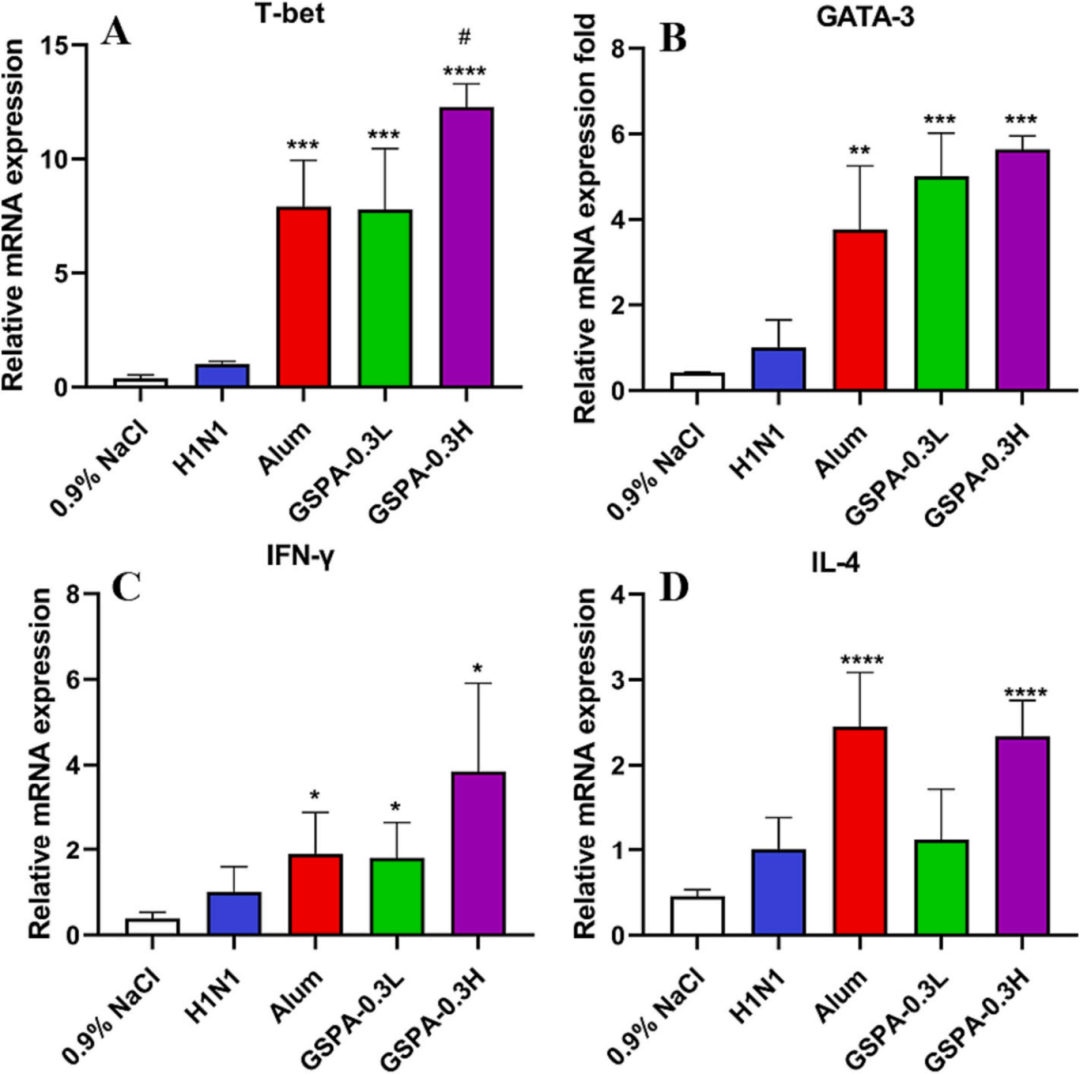
图13 RT-PCR检测T-bet (A)、GATA-3 (B)、IFN-γ (C)、IL-4 (D) mRNA转录水平
组织学观察显示,GSPA-0.3增强了免疫小鼠脾脏白髓生发中心和边缘带淋巴细胞数量,脾小体体积也增大,这些变化提示GSPA-0.3增强了免疫小鼠对H1N1疫苗的免疫应答。
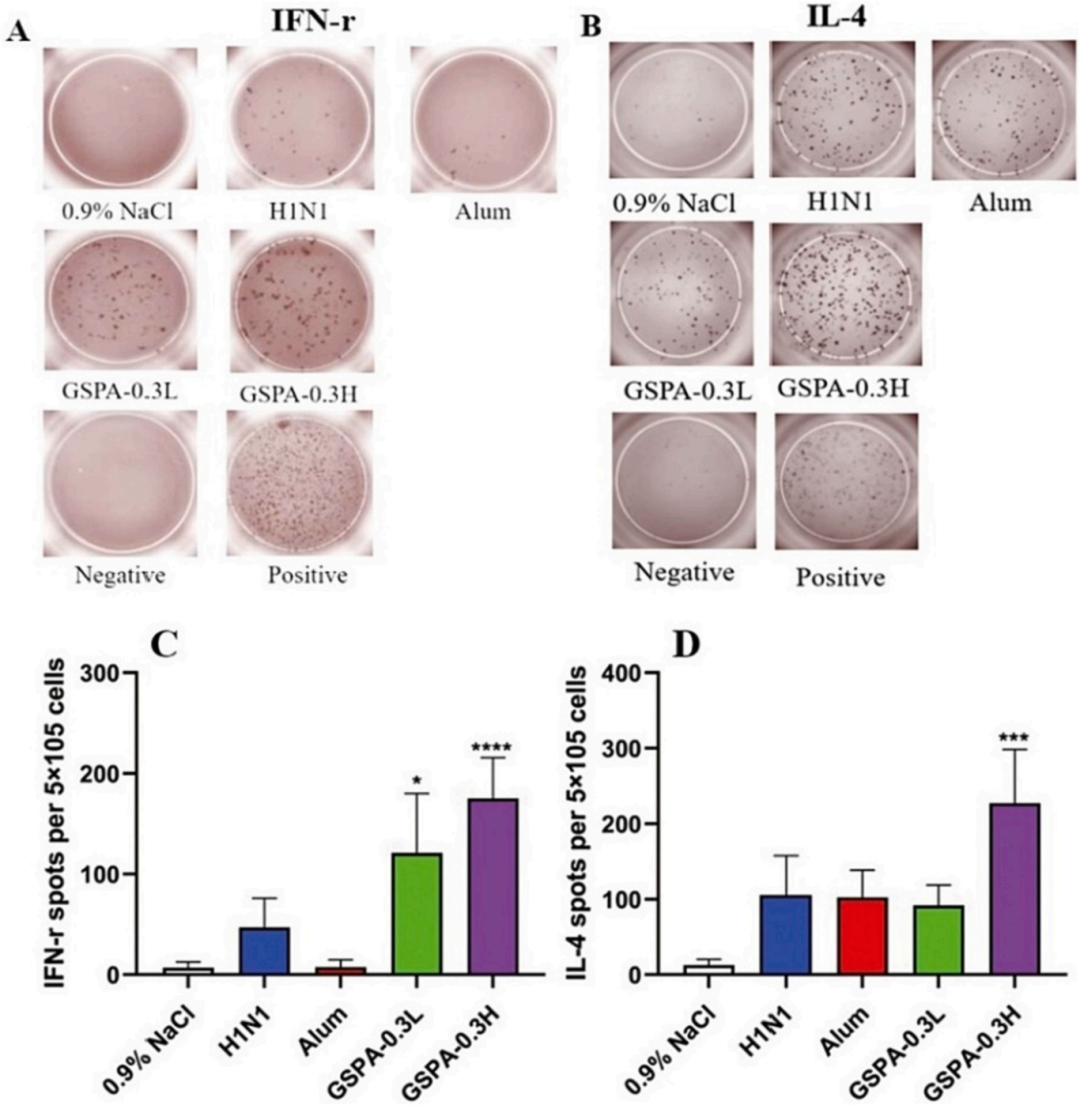
图14 GSPA-0.3对免疫小鼠IFN-γ和IL-4水平的影响
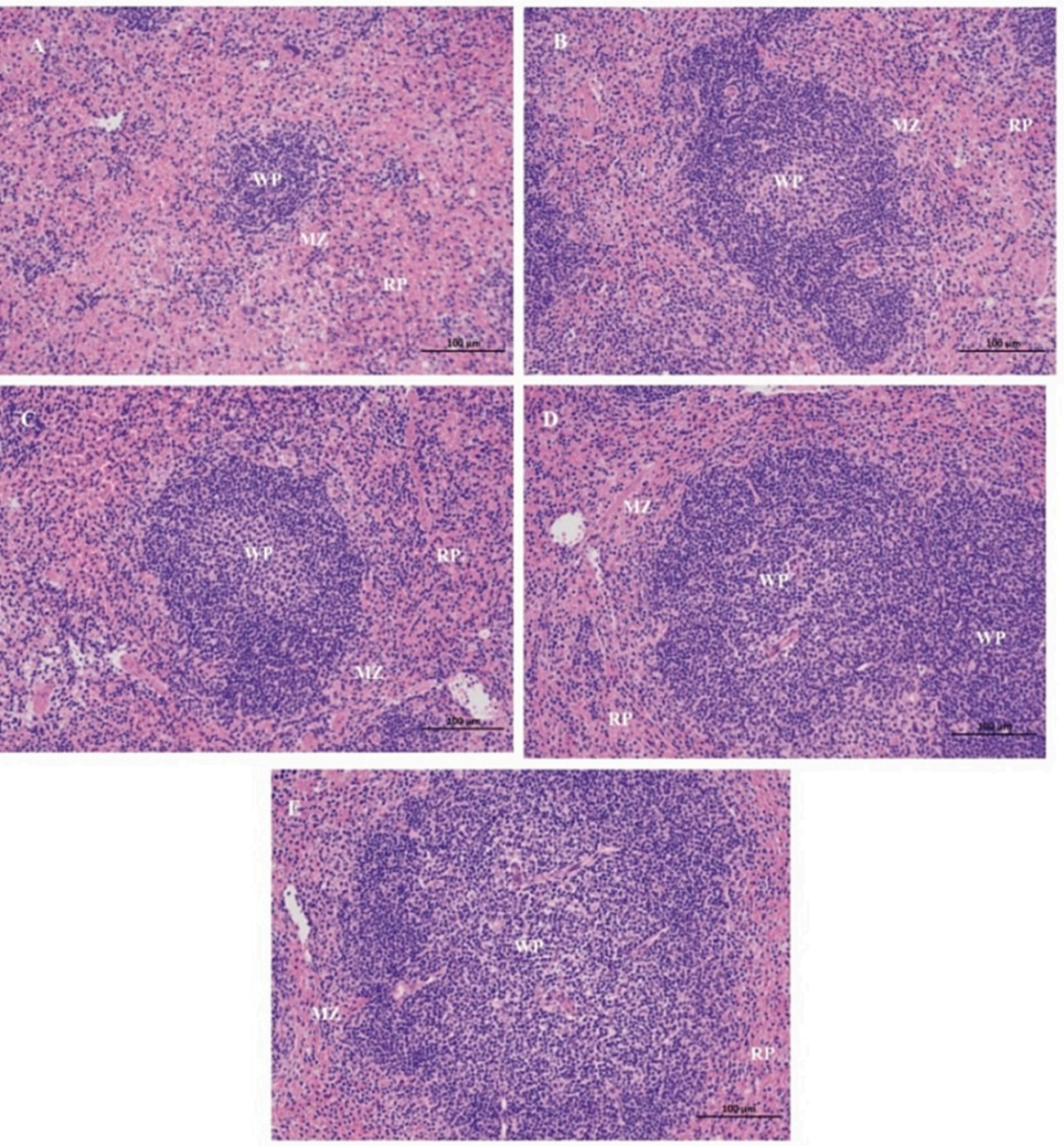
图15 小鼠脾脏HE染色
10. 体外实验结果
在24小时内,GSPA-0.3显著增强DC2.4细胞活力,但高剂量在48小时后对细胞具有毒性。GSPA-0.3通过增加CD11c+/CD80+、CD11c+/CD86+和CD11c+/MHCII的表达来促进DC2.4细胞的成熟,但高剂量(400 μg/mL)的影响略有减弱。GSPA-0.3促进了DC2.4细胞对FITC-OVA抗原的摄取,显示其作为免疫佐剂的潜力。
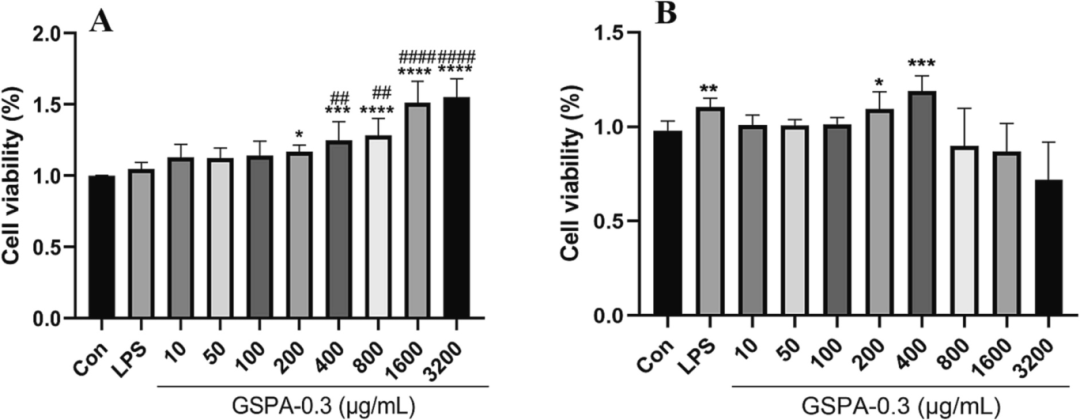
图16 GSPA-0.3对DC2.4细胞作用24 h (A)和48 h (B)的影响
GSPA-0.3显著上调DC2.4细胞中TLR4、MyD88、TRAF6和NF-κB mRNA的转录水平,表明GSPA-0.3能够激活DC2.4细胞并促进TLR4-MyD88-NF-κB信号通路的活性。
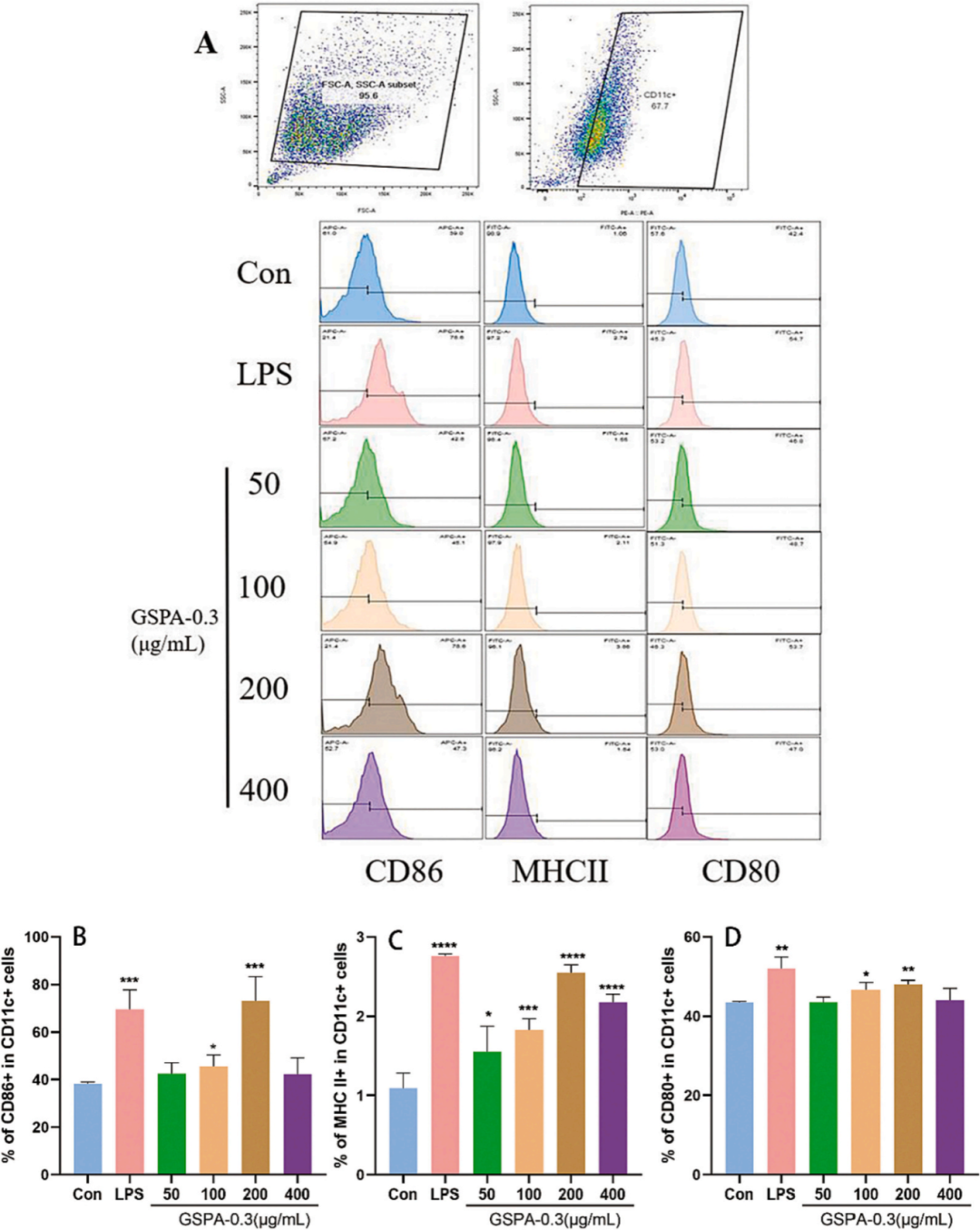
图17 GSPA-0.3对DC2.4细胞成熟的影响(A-D)
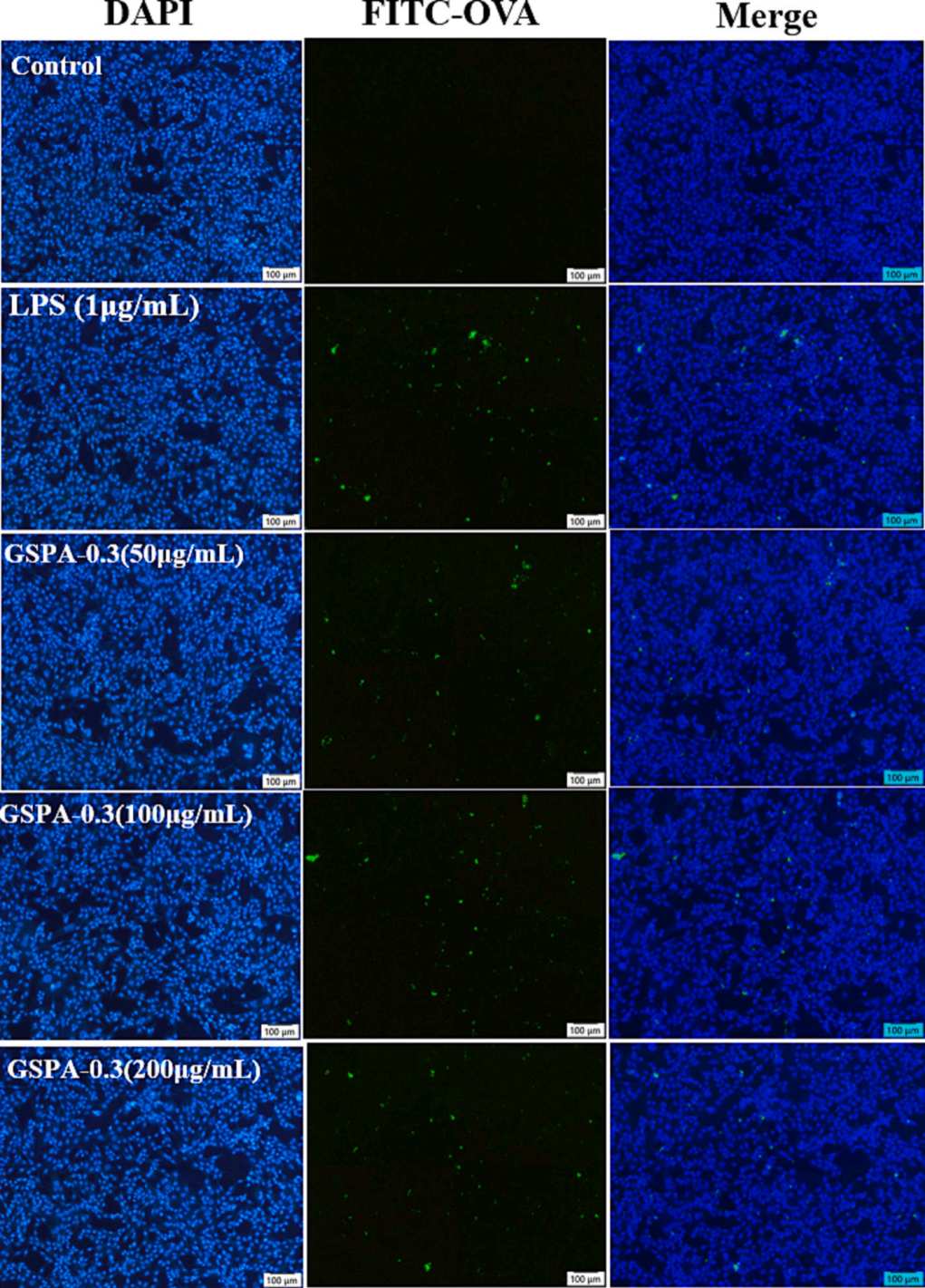
图18 GSPA-0.3增强DC2.4细胞的抗原摄取

图19 GSPA-0.3上调DC2.4细胞中TLR4、MyD88、TRAF-6、NF-κB mRNA转录水平
通过Western blot分析,GSPA-0.3显著提高了DC2.4细胞细胞核中NF-κB、MyD88、TRAF-6和TLR4蛋白的表达水平,进一步验证了GSPA-0.3激活TLR4-MyD88-NF-κB信号通路的作用。
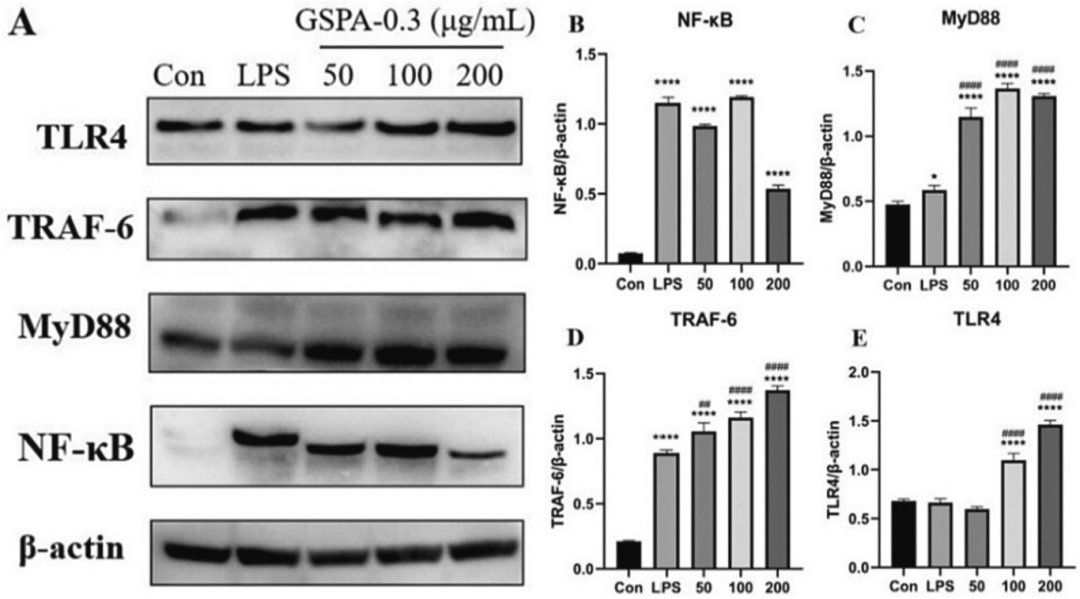
图20 GSPA-0.3上调DC2.4细胞核中TLR4、MyD88、TRAF-6、NF-κB的表达水平
该研究从人参根中分离到一种新的酸性多糖(GSPA-0.3, Mw: 62,722 Da),并确定其结构主要由半乳糖醛酸、半乳糖、阿拉伯糖、葡萄糖和鼠李糖组成,其中有甘露糖和木糖。GSPA-0.3是一种独特的高支链多糖,其主链由→4)-α-D-galpa-(1→,→3)-α-L-rhap-(1→,和→3,4)-α-D-galpa-(1→组成,与其他已报道的多糖不同。GSPA-0.3的分支程度与其活性有关。这种独特的结构可能是其佐剂活性的基础,因为在人参根中没有发现其他部分具有类似的活性。本文首先通过广泛筛选发现GPSA-0.3的佐剂活性超过Al佐剂。总的来说,本研究的结果强调了GSPA-0.3作为H1N1疫苗有希望的辅助候选物的潜力。
三黍生物拥有行业内领先专业多糖检测分析平台,助您快速获得优质多糖理化指标数据,推进研究进展。
如果您需要任何测定分析上的帮助,欢迎后台联系我们咨询技术细节!
更多推荐:
左滑查看更多:
排版:野凌
审核:三黍生物企宣部




