文献解读 | 南京中医药大学破解传统中药!IF 14.7/Q1多组学设计思路揭示多糖肠道改善功能


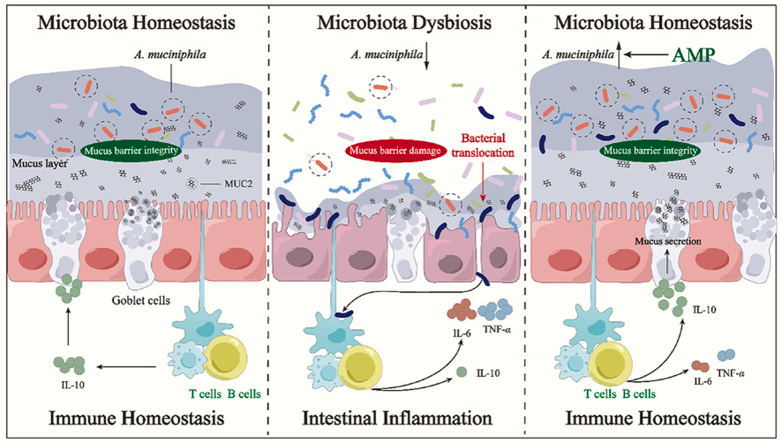
肠道粘液屏障损伤使细菌与上皮紧密接触,导致肠道炎症,因此,屏障恢复是缓解肠道炎症的一种很有希望的策略。
2024年4月发表在Acta Pharm Sin B上的题为“Abelmoschus manihot polysaccharide fortifies intestinal mucus barrier to alleviate intestinal inflammation by modulating Akkermansia muciniphila abundance”的文章中,作者发现黄蜀葵多糖 (AMP) 能够通过增加粘液产生来强化肠道粘液屏障,这在AMP介导的结肠炎改善中起着至关重要的作用。

研究对象:小鼠
技术方法:小鼠实验,灌胃,HE染色,qRT-PCR,微生物组,转录组
图片摘要:
1.AMP减轻急性肠胃炎小鼠的肠道炎症并恢复粘液屏障
作者用DSS造模后,分别使用不同浓度AMP喂养小鼠,结果表明,与模型组相比,高浓度组(400mg/kg)的小鼠腹泻较轻,且体重恢复更快,结肠炎造成的结肠缩短和脾肿大也有所改善(图1A-D)。组织切片结果显示,肠道粘液屏障相关的MUC2分泌和杯状细胞数量在多糖组中增加,并以剂量依赖性方式增加肠黏液屏障的厚度(图1E-J)。HE染色结果中,高剂量的AMP显著改善了肠道炎症(图1K-L)。
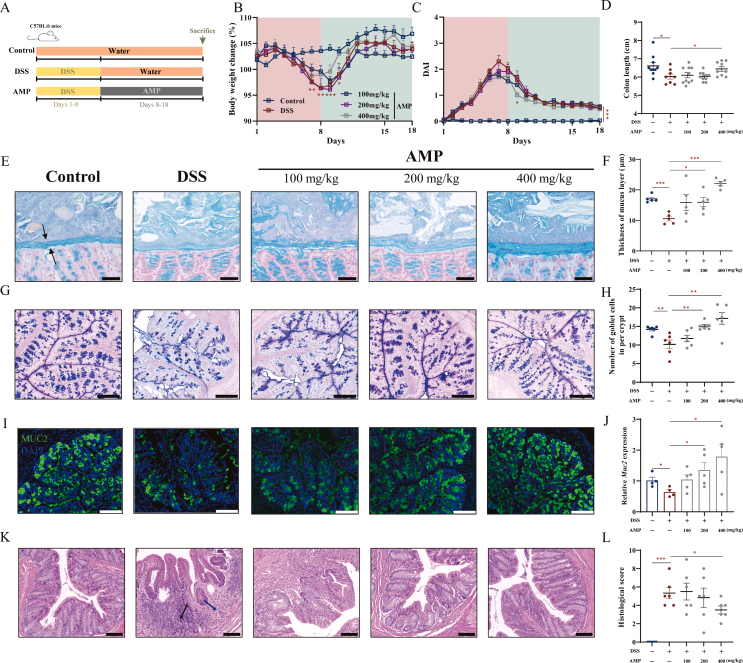 图1 AMP缓解了急性结肠炎小鼠模型中的肠道炎症
图1 AMP缓解了急性结肠炎小鼠模型中的肠道炎症
为了确认AMP是否改善了杯状细胞功能,作者评估了内质网(ER)应激和MUC2的O-糖基化相关基因的表达,结果显示,DSS造成的ER应激相关基因表达改变被AMP处理改善,O-糖基化核心基因的下调也被恢复(图2A-C)。肠粘膜的损伤可能导致微生物的入侵,共聚焦成像结果中,模型组的肠道微生物群与肠上皮细胞之间的距离缩短,AMP阻止了肠道微生物的侵入(图2D-E)。
这些结果表明,AMP强化了DSS诱导的结肠炎小鼠的肠道粘液屏障。
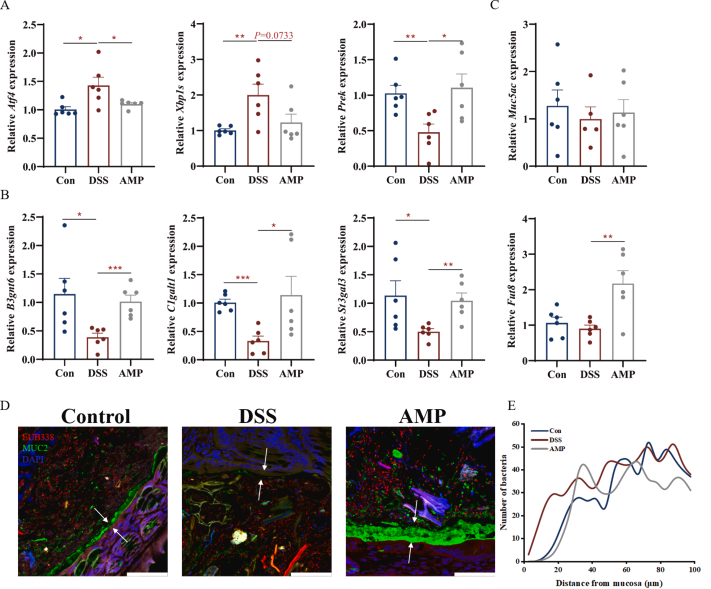
图2 AMP改善了结肠炎小鼠的粘液屏障功能
2.AMP改善慢性结肠炎小鼠的粘液屏障功能
作者随后诱导了慢性结肠炎小鼠模型(图3A),与急性模型小鼠一致,AMP处理后,小鼠对DSS诱导的慢性结肠炎的易感性降低,DAI评分,粪便含水量和结肠长度,和远端结肠的组织病理学均有所改善(图3B-E)。
在肠道粘液屏障损伤的研究中,模型组的肠黏液分泌减少,AMP显著恢复了肠黏液的厚度,也阻止了肠道微生物进入肠上皮细胞(图3F-I)。
这些数据表明,AMP恢复肠道粘液屏障功能可以缓解急性和慢性的结肠炎。
 图3 AMP减轻了慢性结肠炎小鼠的肠道炎症
图3 AMP减轻了慢性结肠炎小鼠的肠道炎症
3.粘液屏障增强在AMP介导的结肠炎改善中起着至关重要的作用
MUC2是肠道粘液屏障的重要组成部分,其缺乏会导致屏障损伤,进而诱发自发性结肠炎。前述实验中的数据表明,MUC2蛋白和mRNA转录水平在AMP处理中有所恢复,为了进一步确认这是否和肠道炎症的改善有关,作者使用MUC2敲除小鼠进行了后续研究(图4A)。
与野生型小鼠相比,敲除鼠的小鼠体重增加较低,且DAI,粪便含水量和结肠萎缩的严重程度增加,杯状细胞萎缩,黏液层变薄,导致炎性细胞浸润和促炎细胞因子分泌(图4B-H),而AMP并无显著改善。
这些数据表明,粘液分泌增强在AMP介导的结肠炎改善中起着至关重要的作用。
 图4 粘液分泌增强在AMP介导的结肠炎改善中起关键作用
图4 粘液分泌增强在AMP介导的结肠炎改善中起关键作用
4.AMP对粘液产生的影响取决于IL-10而不是IL-22
IL-22是可以触发针对肠道屏障损伤免疫反应的细胞因子,但AMP对其并无影响。IL-10是另一种重要的抗炎因子,能够被AMP处理影响。在IL-10敲除小鼠中,造模后出现的结肠炎症状并没有被AMP改善,黏液层的改善作用也失效了(图5A-G)。这证明了IL-10在粘液产生和结肠炎改善中的关键作用。流式细胞仪检测结果中,结肠固有层中的IL-10阳性细胞显著减少(图5H-I),AMP显著增加了固有层中阳性T细胞和B细胞的比例(图5J-K)。
这些数据表明,AMP以IL-10依赖性方式改善肠道炎症和粘液屏障功能。
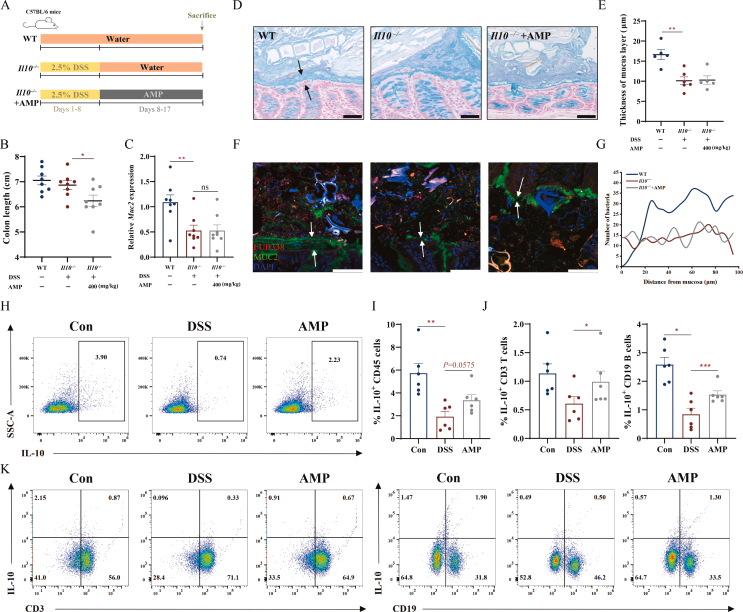 图5 AMP对粘液产生的影响取决于IL-10
图5 AMP对粘液产生的影响取决于IL-10
5.AMP改善肠道菌群失调并增加嗜黏蛋白阿克曼菌的丰度
从急性结肠炎小鼠的粪便16S检测结果显示,造模后肠道菌群的α多样性显著降低,AMP小鼠的均匀度和多样性高于DSS组,结肠炎菌群构成的改变也被AMP改善(图6A-D)。相对丰度分析结果,疣微菌门的细菌在AMP组中富集(图6E)。此外,嗜黏蛋白阿克曼菌的丰度在DSS中降低,AMP显著恢复了其丰度(图6F-H)。
这些结果表明,AMP可以恢复肠道微生物群的稳态,并特异性调节嗜黏蛋白阿克曼菌的丰度。
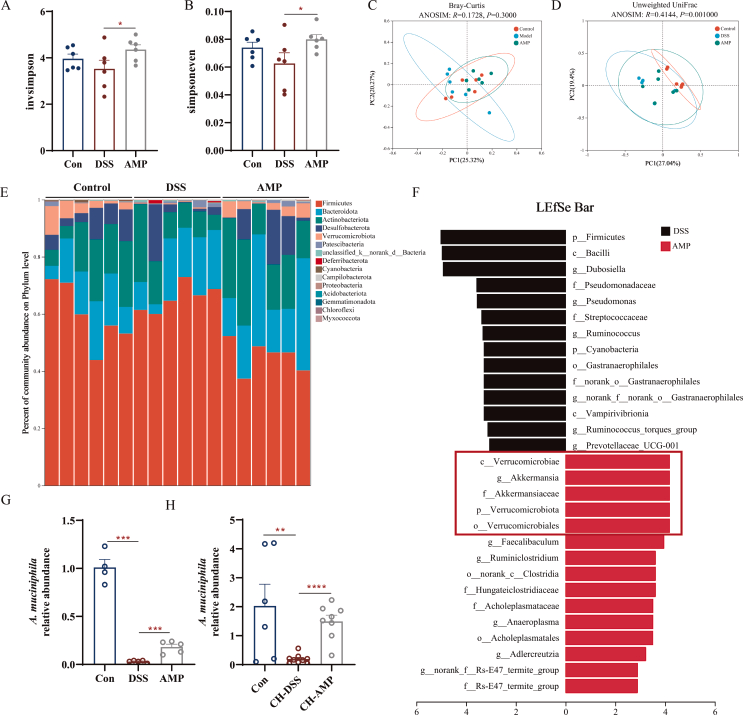 图6 AMP改善了肠道微生物群失调并增加了嗜黏蛋白阿克曼菌的丰度
图6 AMP改善了肠道微生物群失调并增加了嗜黏蛋白阿克曼菌的丰度
6.AMP对粘液产生的IL-10分泌的影响取决于嗜黏蛋白阿克曼菌
通过使用广谱抗生素混合物处理小鼠,作者直接评估肠道微生物在AMP生物功能中的作用(图7A)。在抗生素处理小鼠中,促炎细胞因子产生减少,MUC2转录和粘液厚度减少,近端结肠杯状细胞受损,然而,抗生素没有治疗效果(图7B-F)。抗生素处理后IL-10转录降低,而AMP无法逆转该趋势,也无法保护粘液屏障。这些数据表明,AMP通过调节结肠炎小鼠的肠道微生物群来修复肠道粘液屏障。
为了证实嗜黏蛋白阿克曼菌的作用,作者给抗生素处理的野生型小鼠进行了单菌灌胃,随后辅以AMP给药,这显著增加了肠黏液层的厚度(图7J-K),尽管肠道微生物缺失后AMP诱导的IL-10促进作用消失,但嗜黏蛋白阿克曼菌灌胃定值后,这种作用得以恢复(图7B-L)。
这些发现表明,嗜黏蛋白阿克曼菌在AMP对肠道粘液产生和IL-10分泌的影像中起关键作用。
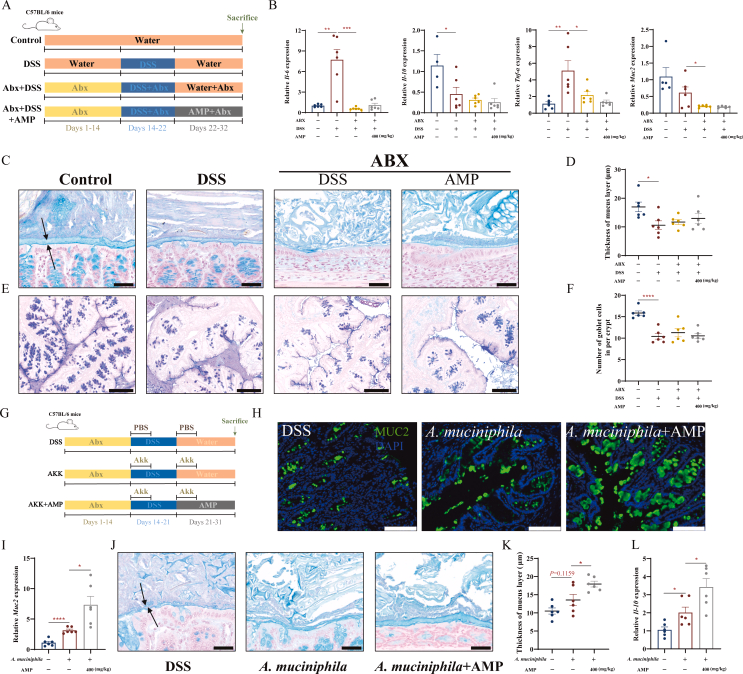 图7 AMP对粘液产生和IL-10分泌的影响取决于嗜黏蛋白阿克曼菌
图7 AMP对粘液产生和IL-10分泌的影响取决于嗜黏蛋白阿克曼菌
7.AMP通过上调微生物基因的表达,调节细胞生长和能量代谢,直接促进嗜黏蛋白阿克曼菌的生长
为了进一步阐明AMP对嗜黏蛋白阿克曼菌的影响,作者进行了体外培养,在添加了粘蛋白的BHI培养基中,AMP促进了细菌的生长,在无粘蛋白的培养基中生长缓慢(图8A-B)。细菌的转录组测序结果显示,AMP处理后,与细胞生长和能量代谢相关的基因表达上调。功能分析结果表明,上调的基因主要参与细胞壁、膜生物合成、蛋白质翻译以及碳水化合物转运和代谢(图8C-E)。
这些数据表明,AMP能通过调节微生物基因直接增强嗜黏蛋白阿克曼菌的生长和代谢功能。
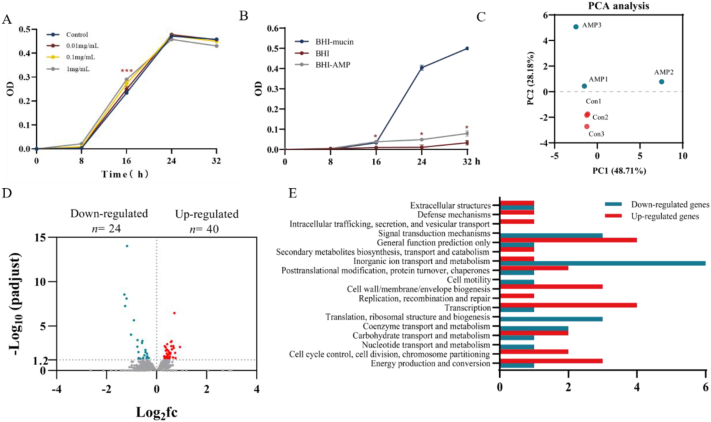 图8 AMP通过上调微生物基因表达直接促进嗜黏蛋白阿克曼菌的生长
图8 AMP通过上调微生物基因表达直接促进嗜黏蛋白阿克曼菌的生长
在这项研究中,作者通过小鼠实验和多组学数据证明,AMP能够通过恢复结肠炎小鼠嗜黏蛋白阿克曼菌的丰度,来促进IL-10的分泌,从而促进MUC2分泌,改善肠道粘液屏障功能,并最终改善结肠炎小鼠的肠道炎症。
年末预存活动火热进行中!现在参加,有机会获得限量版定制金钞、苹果笔记本、金额增值等优惠!
三黍生物多组学一站式解决方案,为您的科研保驾护航
左滑查看更多:
排版:野凌
审核:三黍生物企宣部






