文献解读
文献解读|Nature Communications不同病因和阶段的肝细胞癌蛋白质基因组特征解析
研究背景
肝癌75-85%为肝细胞癌(HCC),基因组分析表明,TERT启动子、CTNNB1(编码β-连环蛋白)和TP53(编码p53)在HCC中经常发生突变,而参与氧化应激反应、染色质重塑和肝细胞分化等关键过程的基因则反复发生突变,但HCC2-4中的突变率低于10%。转录组层面的分子分型分析显示,HCC不同亚型在细胞增殖、干细胞功能、代谢、肝细胞分化和肝功能相关的基因表达上存在差异。之前主要是关于早期和HBV相关的HCC的蛋白质组研究,但对其磷酸化蛋白质组的描述相对较少。2022年5月Nature Communications发表题为“Integrative proteogenomic characterization of hepatocellular carcinoma across etiologies and stages”的论文,研究人员基于高通量磷酸化蛋白质组为核心的多组学技术对不同病因和临床阶段的HCC样本进行蛋白质基因组分析,不仅揭示HCC的广泛分子异质性,还概述了HCC的蛋白质组学和磷酸化蛋白质组学的分子分型,揭示了肝癌不同亚型发生发展中关键的调控通路,对肝癌的发生发展分子机制以及药物潜在靶点研究具有重要意义。

研究材料
114名患者的122份HCC活检样本和115份非肿瘤组织
研究结果
1.多组学分析HCC的通路变化
研究收集了114名患者的122个肿瘤的活检标本,进行全外显子组测序和RNA测序,并对51种肿瘤子集进行DIA蛋白质组和非标记磷酸化蛋白质组分析。主成分分析表明,HCC在转录组、蛋白质组和磷酸化蛋白质组水平上与正常肝脏不同,且变化更大。为了确定HCC中相关途径的变化,对HCC转录组和蛋白质组与正常肝脏进行了差异表达分析,观察到转录组和蛋白质组之间存在中度相关性;同时四象限分析的结果显示在这两个组学水平上不同通路表达上调和下调的情况,如:mRNA剪接相关的通路整体上调,与正常肝功能相关的通路下调,翻译控制相关通路仅在mRNA水平上调,与凝血和补体相关的通路仅在蛋白水平上调。
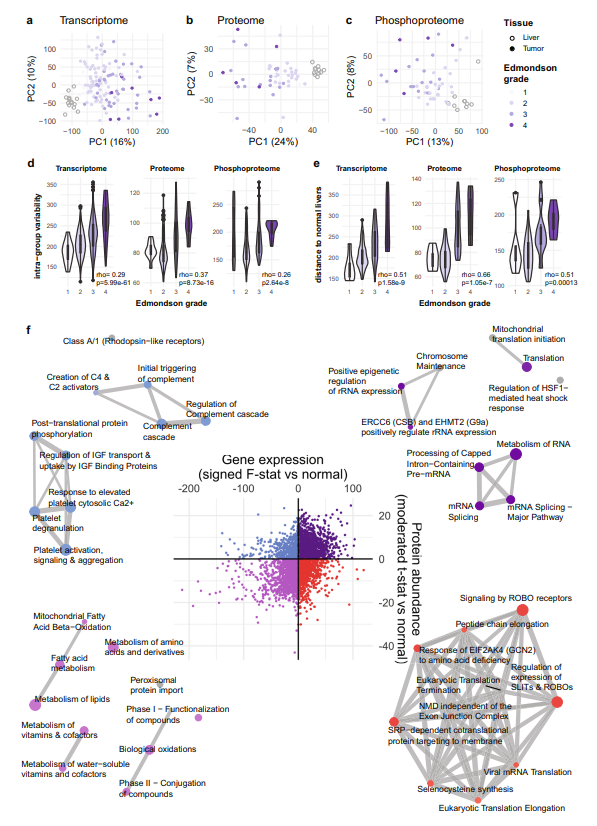
图1 HCC中发生变化的通路
2. CNA-mRNA-protein相关分析确定候选驱动基因
研究人员评估了拷贝数改变(CNA)、mRNA表达和蛋白质(protein)表达之间的相关性,重点研究了136个表现出高CAN-mRNA和mRNA-protein相关性的基因,特别是通过GISTIC2分析后的5个CNA区域内的29个基因,这些基因在27–61%的队列中获得或丢失。在这29基因中,有19个在mRNA水平上失调,11个在蛋白质水平上失调,9例在这两个水平上失调(ATP6V1C1、BYSL、CHD1L、NUDCD1、LRRC47、RRM2B、UBQLN4、XPO5、YWHAZ)。CAN-mRNA和mRNA-protein表达相关性的分析表明,不同的途径在不同水平上受到调节,并确定了潜在的HCC驱动基因,如NUDCD1、UBQLN4、BYSL、ATP6V1C1和RRM2B,它们参与多种过程,包括EMT、细胞周期和DNA损伤调节,以及Wnt-β-连环蛋白、AKT \/mTOR和Notch通路的调节。
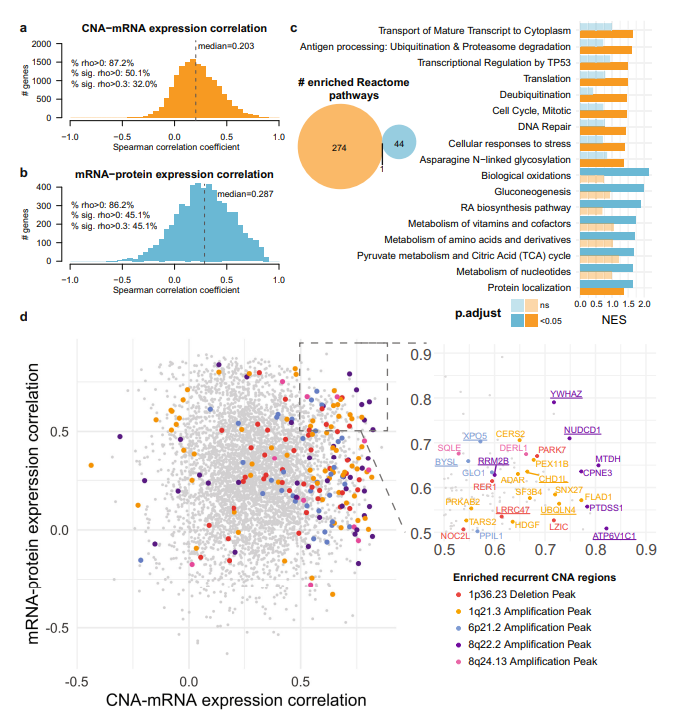
图2 CNA mRNA与蛋白质的相关性
3. 肝癌中蛋白磷酸化水平明显改变
接下来,研究了HCC中的蛋白质磷酸化情况。差异表达分析显示,与正常肝脏相比,高磷酸化和低磷酸化位点分别为692个和648个,富集分析显示,高磷酸化位点位于参与细胞周期、mRNA剪接、免疫系统、癌症相关信号通路(如受体酪氨酸激酶和MAP激酶)以及PTEN和p53调节的蛋白质中,AKT、FGFR、VEGF、TGFβ信号也在高磷酸化蛋白中富集;在次磷酸化位点中,组蛋白修饰相关过程丰富。结果表明,HCC中磷酸化的改变影响了从细胞增殖和DNA修复到免疫系统和信号转导途径的广泛生物学过程。
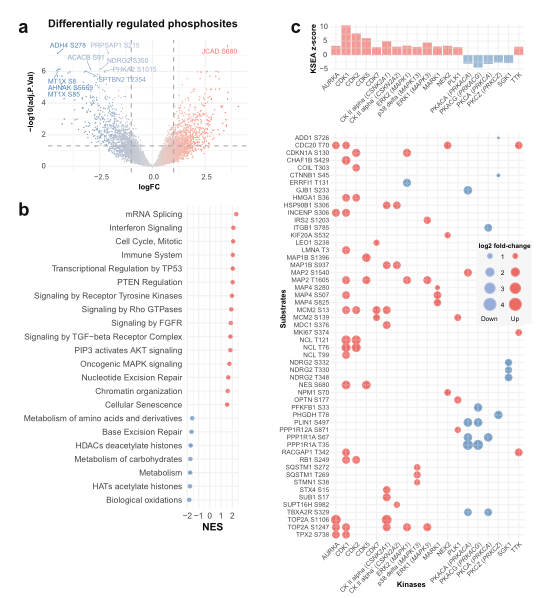
图3 CAN-mRNA与蛋白质的相关性
4.蛋白质基因组分析显著突变基因
利用全外显子组测序,在122例肿瘤活检中鉴定出24488例体细胞突变(23660例单核苷酸变体和828例插入和缺失)。使用MutSigCV和OncodriveFML鉴定了7个显著突变的基因,其中CTNNB1和TP53是HCC中最常见的两个突变基因,为了评估与CTNNB1和TP53突变相关的分子变化,进行了差异表达。在CTNNB1突变体中鉴定出3067个差异表达基因,在TP53突变体HCC中鉴定出3949个差异表达基因;在CTNNB1突变体中鉴定出23个差异表达蛋白,在TP53突变体HCC中鉴定出399个差异表达蛋白。蛋白质基因组分析表明,CTNNB1突变HCC中出现的上皮表型缺失可能是由于参与肌动蛋白丝组织的蛋白质磷酸化的改变,从而调节细胞极性和迁移,而TP53突变HCC与脂质代谢和细胞周期控制相关蛋白的磷酸化改变有关。

图4 SMG的蛋白质基因组分析
5. 肝癌的分子分型
蛋白质组和磷酸蛋白质组都鉴定出两个簇。蛋白质组亚型1与核糖核蛋白组织、mRNA剪接和加工相关,而亚型2参与代谢和氧化磷酸化;磷酸蛋白质组亚型1也与核糖核蛋白组装、mRNA剪接和加工有关,磷酸蛋白质组亚型2与端粒维持、核小体组织、DNA修复、肌动蛋白细胞骨架调节和PKA C-α激活相关。蛋白质组簇与Edmondson分级和Hoshida分子亚型相关。为了评估单个组学和综合分子亚型是否具有预后,进行了单变量和多变量Cox比例风险分析。总之,虽然蛋白质组数据的分子聚类在很大程度上概括了转录组和组织学分级的分子聚类,但磷酸化蛋白质组数据的分子聚类不同于其他单一组学和综合聚类。
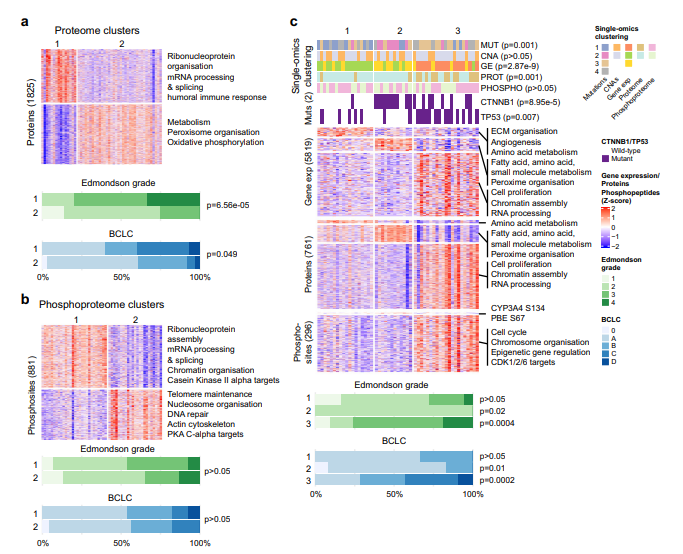
图5 肝癌的蛋白质组分子分型
小结
肝细胞癌(HCC)的蛋白质基因组学分析集中于早期HBV相关HCC。该研究对CAN-mRNA-protein相关性、磷酸化蛋白质组和HCC整合簇的分析提出了一些推测的驱动因素和药物靶点。研究描述了参与上皮细胞向间充质细胞转化的候选拷贝数驱动基因,Wnt-β-连环蛋白,AKT \/mTOR和Notch途径,细胞周期和DNA损伤调节。CTNNB1和TP53突变分别与肌动蛋白丝组织和脂质代谢相关的蛋白磷酸化改变相关。整合蛋白基因组簇表明,HCC构成异质亚群,具有明显的生物过程调节、代谢重编程和激酶激活。该研究全面概述了HCC的蛋白质组学和磷酸化蛋白质组学,揭示了蛋白质组中改变的主要途径。
三黍项目推荐




