文献解读 | 国自然季,热点机制研究怎么设计?来看北京协和医学院NC多组学思路拆解

TNF 抑制剂已被用于治疗自身免疫性和自身炎症性疾病,白塞病(BD)是一种自身免疫性炎症性疾病。
2024年4月发表在Nature Communication上的题为“TNF inhibitors target a mevalonate metabolite/TRPM2/calcium signaling axis in neutrophils to dampen vasculitis in Behçet's disease”的文章中,作者使用血清代谢组学和外周免疫细胞转录组学,发现BD患者的多形核中性粒细胞 (PMN) 具有失调的甲羟戊酸通路,法呢基焦磷酸(FPP)水平升高,最终发现了 FPP-TRPM2-TNF/NETs 反馈回路对炎症加重的影响,以及TNF抑制剂治疗对BD的新见解。

研究对象:临床BD患者和健康对照血清、PBMC、PMN,小鼠
技术方法:代谢组、脂质组、转录组、单细胞转录组、炎症因子检测、基因敲除小鼠构建、免疫荧光染色等
技术路线:

1.多组学分析强调了 MVA 通路在 BD-PMN 过度激活中的促炎作用
作者整合了已发表的多组学的数据,包括BD患者和健康对照的血清代谢组,脂质组,PBMC和PMN的转录组测序,PBMC的单细胞RNA测序。结果表明,与HC相比,BD血清中的类固醇生物合成途径显著上调(图1A),单个免疫群的分析结果显示,血清中的这种代谢改变主要发生在BD-PMN中(图1B)。类固醇的下游通路中,BD-PMN 的胆固醇生物合成途径显著增加,但胆汁酸和类固醇激素的合成途径却没有增加(图1C)。随后,作者从BD-PMN和HC-PMN的转录数据检查了胆固醇生物合成途径中关键酶的表达谱,并在独立的20例BD患者队列中通过qRT-PCR的方法进行了验证(图1D),结果显示,表达差异最大的酶,包括ACAT1、MVK、PMVK 和MVD,都集中在胆固醇生物合成的上游途径,即 MVA 途径(图1E)。
这些结果表明,BD-PMN 中的 MVA 通路发生了特异性上调。
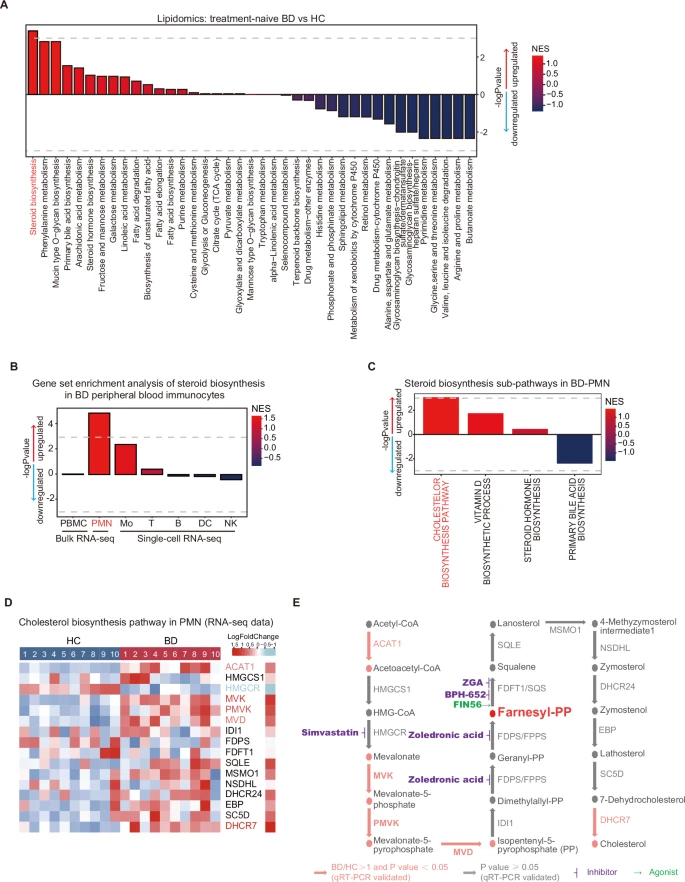
图1 多组学分析凸显了BD患者中MVA途径的上调
为了确定MVA通路的作用,作者通过使用辛伐他汀和唑来膦酸分别抑制了控制 MVA 通路起点和终点的酶(图1E),结果显示两种抑制剂都能抑制BD-PMN的促炎细胞因子(图2A-B)。MVA 通路的最终产物是法尼基焦磷酸(FPP),由GPP转化而来,作者推测FPP可能是参与MVA通路诱导BD-PMN超活化的主要成分。为了验证该假设,作者分别抑制和激活了通路关键酶角鲨烯合成酶(FDFT1)的功能,结果表明,FPP在细胞内的积累增加了BD-PMN中促炎细胞因子的产生,反之亦然(图2C-E),且对PMN的活力无影响,这表明 FPP 在 PMN 中具有促炎作用。
这些结果表明,MVA通路,尤其是其代谢产物 FPP,在PMN活化和炎症中起着促炎作用。
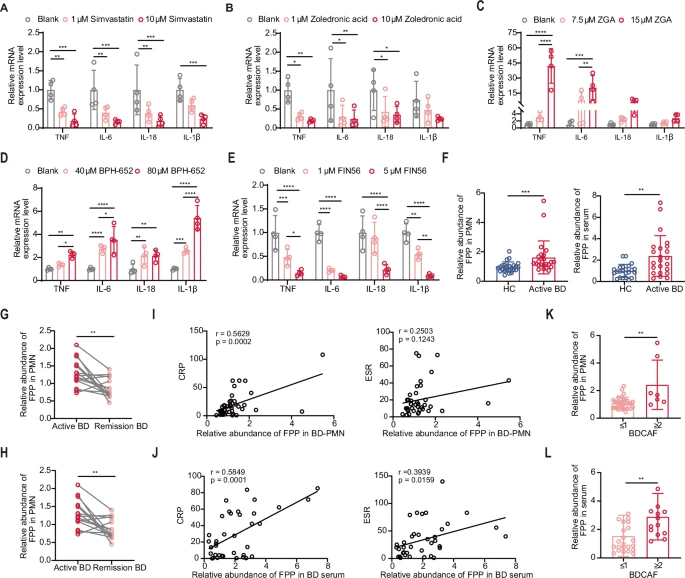
图2 FPP是BD-FMN炎症中的关键代谢物
2.BD患者的FPP水平升高且与疾病活动相关
作者通过靶向代谢的方法进一步检测了FPP在血清和PMN样本中的丰度,与HC相比,活动性BD患者的两种样本中的FPP相对水平均升高(图2F),纵向随访数据表明,在BD患者有所缓解后,PMN和血清中的FPP水平显著下降(图2G-H)。临床数据的评估结果显示,PMN中的FPP水平与C反应蛋白(CRP)呈正相关,而血清中的FPP水平则与CRP和红细胞沉降率(ESR,BD疾病活动性的指标)均呈正相关(图2I,J),活动性高的患者样本中的FPP水平显著高于低活动性的患者,具有心外血管受累(包括深静脉血栓和动脉瘤)的BD患者的血清FPP水平明显高于心脏受累患者。ROC曲线的结果中,FPP的AUC值为0.7467。
这些结果暗示了FPP刺激下DAMPs介导的PMN炎症和坏死的直接效应。
3.BD-PMN对外源FPP的增强反应性促进了PMN的过度激活及血管内皮的炎症和损伤
作者在体外化学合成了FPP,并研究了其对PMN、淋巴细胞和单核细胞的促炎性细胞因子表达的影响,数据显示,PMN中促炎性细胞因子的产生增加,但淋巴细胞和单核细胞无影响,且D-PMN的反应性高于HC-PMN(图3A-D)。在FPP以剂量依赖的方式刺激了PMN中促炎性细胞因子的产生(图3E),且未影响其存活率,随着浓度增加,60 µg/mL FPP诱导了PMN、单核细胞和淋巴细胞的死亡,且BD患者PMN中的反应性更强(图3F-H)。与CRP正相关的NETs来源的dsDNA,在活动性BD患者中也显著高于HC组(图3I),随访结果表明,治疗后缓解期的BD患者血清NETs-dsDNA水平显著下降(图3J)。此外,60 µg/mL FPP刺激的BD-PMN上清液比HC的上清液引起了血管内皮细胞(VEC)的更强烈炎症反应,表现为促炎性细胞因子和黏附分子的上调(图3K)。
这些数据表明,FPP特异性触发PMN过度激活和VEC炎症,并增强BD-PMN的反应性。
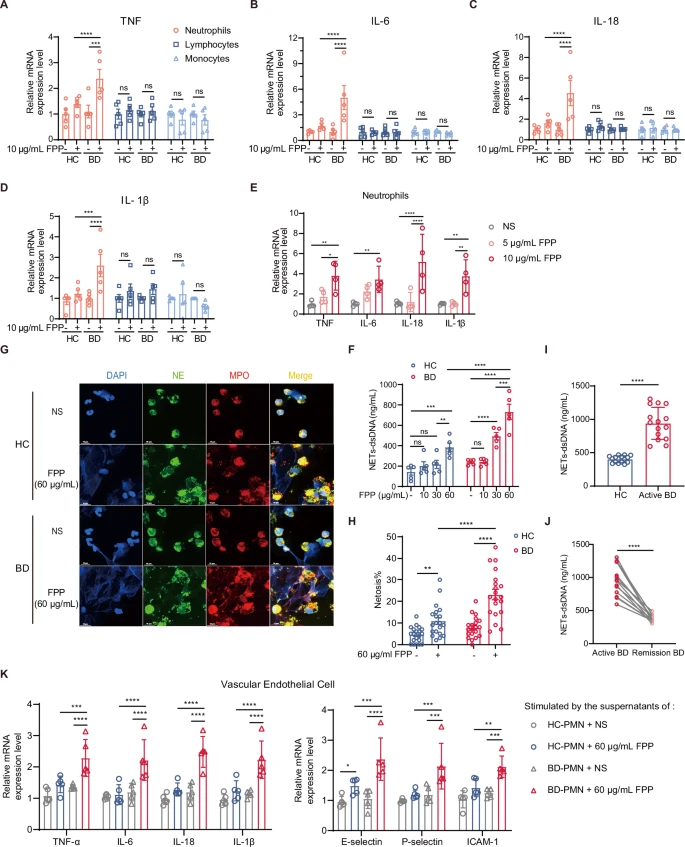
图3 FPP对PMN过度激活和血管内皮炎症的影响
4.钙和TRP通道对于FPP诱导的PMN激活至关重要
FPP通过与瞬时受体电位(TRP)通道相互作用引发钙离子内流,进而引起基因转录和细胞免疫反应。为了验证钙离子的作用,作者在存在和不存在钙的情况下使用了通用抑制剂红钌(RR),这两种条件均抑制了FPP诱导的钙内流、细胞因子产生(图4A)和PMN的NETosis(图4B-D),这表明钙和TRP通道对FPP促进PMN过度激活至关重要。此外,RR显著减弱了FPP对NETosis诱导的VEC激活的影响(图4E)。NETs-dsDNA降解后,VEC中促炎性细胞因子和黏附分子的表达显著降低(图4C、E),这表明NETs是FPP刺激PMN上清液中诱导VEC炎症的关键成分。TRP通道介导了BD-PMN对FPP刺激的增强反应(图4F、G)。流式细胞术的结果显示,在FPP刺激下,BD-PMN比HC-PMN表现出更强的钙离子内流(图4H)。
这些结果表明,FPP诱导的PMN活化机制依赖于通过TRP通道的钙离子内流。
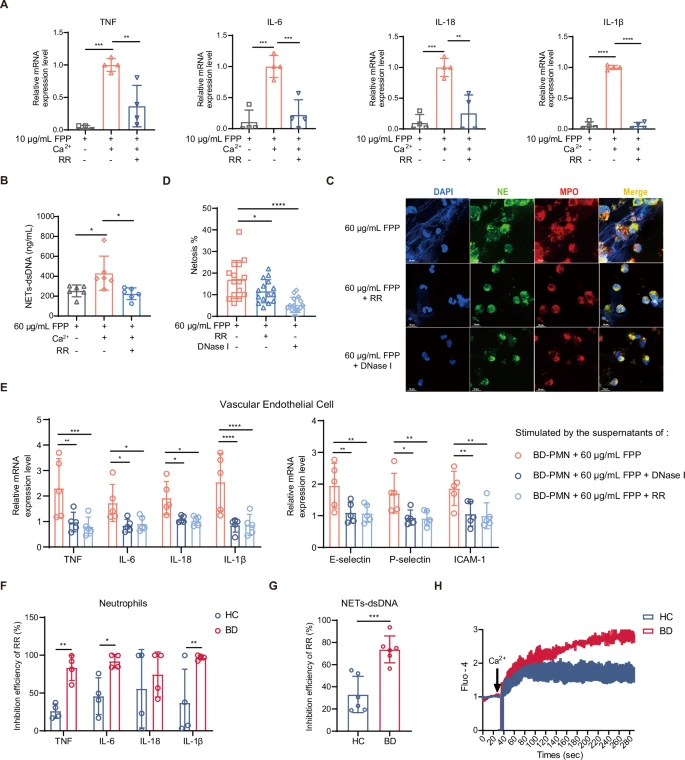
图4 FPP对FMN的促炎作用依赖于钙和TRP通道
5.TNF-TRPM2轴在PMN中引发了FFP诱导的炎症反应
RNA测序数据库中的RR敏感钙通道(TRP通道等)分析结果表明,四个基因(TRPM2、TRPC1、RYR1和MCOLN2)的表达显著升高(图5A),根据qRT-PCR和WB的结果(图5B-C),TRPM2是BD-PMN中FPP反应性增强的主要原因,且TRPM2的表达水平在活动期BD患者中显著高于缓解期(图5D),这暗示TRPM2可能参与BD的进展。BD-PMN中TRPM2的敲低显著改善了FPP诱导的BD-PMN过度激活,表现为促炎性细胞因子(图5E)、NETs(图5F-H)和VEC的炎症反应的降低(图5I)。

图5 TRPM2 表达升高参与了 FPP 诱导的 BD-PMN 炎症反应
使用活动期BD血清培养的HC-PMN的TRPM2表达水平显著高于使用HC血清培养的HC-PMN(图6A),促炎因子的结果中,BD血清中的TNF、IL-6和IFN-γ水平高于HC血清(图6B)。这些数据表明,只有TNF显著增加了PMN上的TRPM2表达(图6C-D),而其他细胞因子如IL-6、IL-18、IL-1β或IFN-γ则没有影响。
临床数据中,经过4个月左右的TNF抑制剂治疗,BD-PMN中的TRPM2表达显著降低(图6E),随访数据也表明,最后检测时间点的BD-PMN中,TRPM2表达显著低于基线水平。此外,体外实验表明,TNF抑制在BD血清中减少了FPP诱导的PMN活化(图6F-G)。
这些数据表明,TNF抑制剂的治疗可以通过下调BD-PMN中TRPM2的表达,减少FPP诱导的PMN活化。
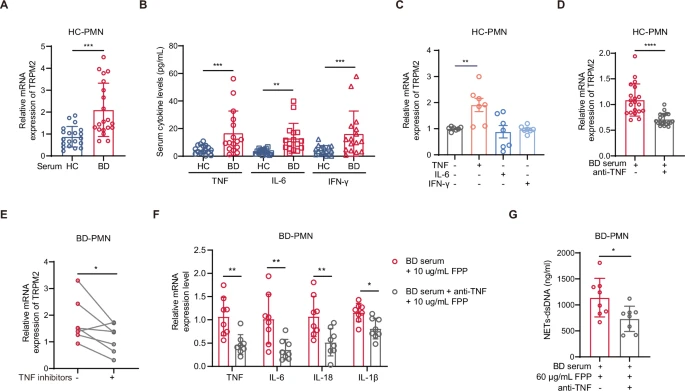
图6 TNF-TRPM2轴在BD-PMN中引发FPP诱导的炎症反应
6.FPP-TRPM2-PMN轴参与小鼠血管炎和自身免疫性葡萄膜炎
为了进一步确认FPP在血管炎症和损伤中的关键作用,作者构建了FPP合成酶(FPPS)敲除小鼠,并诱导了血管炎症。与对照组相比,敲除鼠的血管炎症和损伤降低,表现为中性粒细胞浸润和血管通透性显著降低(图7A-D),敲除鼠皮肤组织中MPO阳性细胞的比例也明显低于对照小鼠(图7E-H)。此外,TRPM2全敲除(TRPM2-KO)小鼠与野生型对照小鼠相比,也表现出显著降低的血管损伤,血管通透性降低(图7I-K)。
这些实验结果表明,FPP-TRPM2-PMN轴在诱导血管炎症中的关键作用。
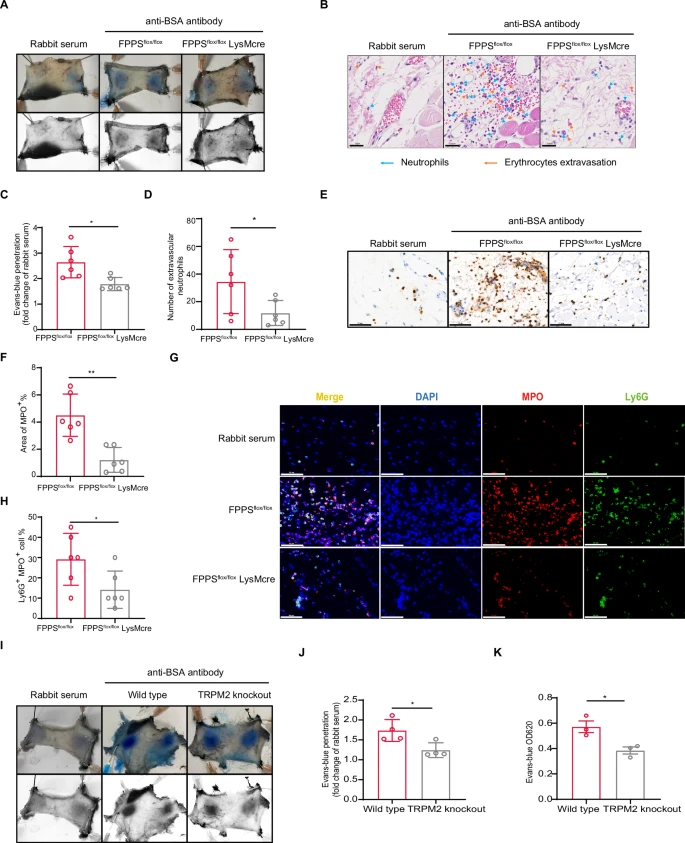
图7 FPPS和TRPM2敲除可有效减轻小鼠的中性粒细胞浸润和血管通透性
在这项研究中,作者通过多组学数据和一系列体外实验结果表明,TNF通过上调TRPM2的表达使PMN对FPP更敏感,而TRPM2的表达与FPP的促TNF和NETs生成效应一起,在BD中导致正向促炎反馈回路。该机制可能也会对其他自身免疫和自身炎症疾病产生影响。


年末预存活动火热进行中!现在参加,有机会获得限量版定制金钞、苹果笔记本、金额增值等优惠!
三黍生物多组学一站式解决方案,为您的科研保驾护航
左滑查看更多:
排版:野凌
审核:三黍生物企宣部






