一作解读 | IF 10+客户优选多糖分析组合首次公开!技术顾问感叹:这也太会设计了……
多糖研究领域竞争激烈,如何脱颖而出,甚至能将文章发表在鼎鼎大名的Carbohydrate Polymers上?
之前我们和大家聊过一篇优秀的高分多糖文章,基本上涵盖两个方面:多糖结构解析和多糖活性功能的分析:
作为专研检测服务,在多糖科研领域有着十年经验积累的国际领先糖化学平台拥有者,三黍生物为我们的客户提供丰富多样的多糖检测服务,无论是结构研究,还是活性研究,都有灵活的选择空间:

三黍生物多糖检测服务,欢迎私信了解详情!
但也因此,我们常常收到客户的咨询:
这么多的检测种类,我应该怎么选?
想要发表一篇高水平的多糖研究文章,什么检测项目适合我?
……

为了直观地解答这个问题,我们特别邀请了刚刚在Carbohydrate Polymers发表了文章的客户老师,首次在本栏目分享多糖的高分研究思路!
一起来看看,一篇IF 10+/Q1的多糖研究文章是如何诞生的吧~
肠道黏膜屏障是人体的第一道防线,对维持健康至关重要。肠道黏膜屏障功能的破坏与多种疾病有关,如炎症性肠病(IBD)、关节炎、心血管疾病、代谢综合征和精神疾病。在许多情况下,黏膜屏障的破坏往往发生在疾病表现之前。因此,调控黏液屏障的完整性是治疗与肠道屏障功能障碍相关疾病的一种可行的治疗策略。
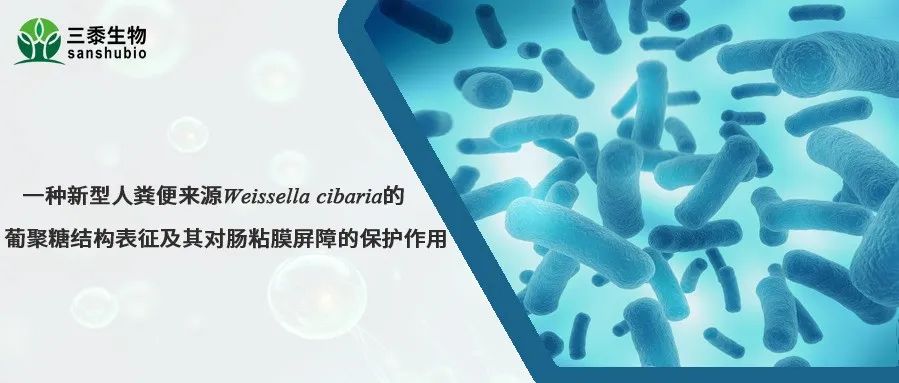
胞外多糖(EPS)是微生物分泌的代谢产物,具有多种生物活性。产自Weissella cibaria的EPS可抗氧化、抗菌、促细胞活力及调节肠道微生物群。但W.cibaria EPS保护肠道黏膜屏障机制尚不明确。本研究从健康婴幼儿粪便中筛选到一株高产EPS的W.cibaria,并对其多糖进行纯化和表征,证明该新型葡聚糖以依赖于肠道微生物和丙酸的方式保护肠道黏膜屏障,从而有助于开发预防和治疗与肠道黏膜屏障功能障碍相关的疾病。

W. cibaria、C57BL/6小鼠、胞外多糖
单糖组成、红外光谱、甲基化分析、核磁光谱、溃疡性结肠炎模型
文章路线图
1.W. cibaria 胞外多糖的制备及结构表征
W.cibaria ZMC030可以蔗糖为碳源发酵产胞外多糖。经醇沉法提取源自W.cibaria ZMC030的粗多糖,进一步经DEAE-cellulose纯化得到高纯度的多糖EPS-1和EPS-2,得率分别为8.6%和53.2%。鉴于EPS-1得率过低,本研究进一步研究了EPS-2的结构和功能。EPS-2的总糖含量高达98.9% ± 0.08%, HPLC洗脱图谱显示EPS-2为单一、对称且狭窄的峰,表明纯化所得EPS–2是均质多糖,分子量为845 kDa。单糖组成分析表明EPS-2是由葡萄糖组成的中性葡聚糖。
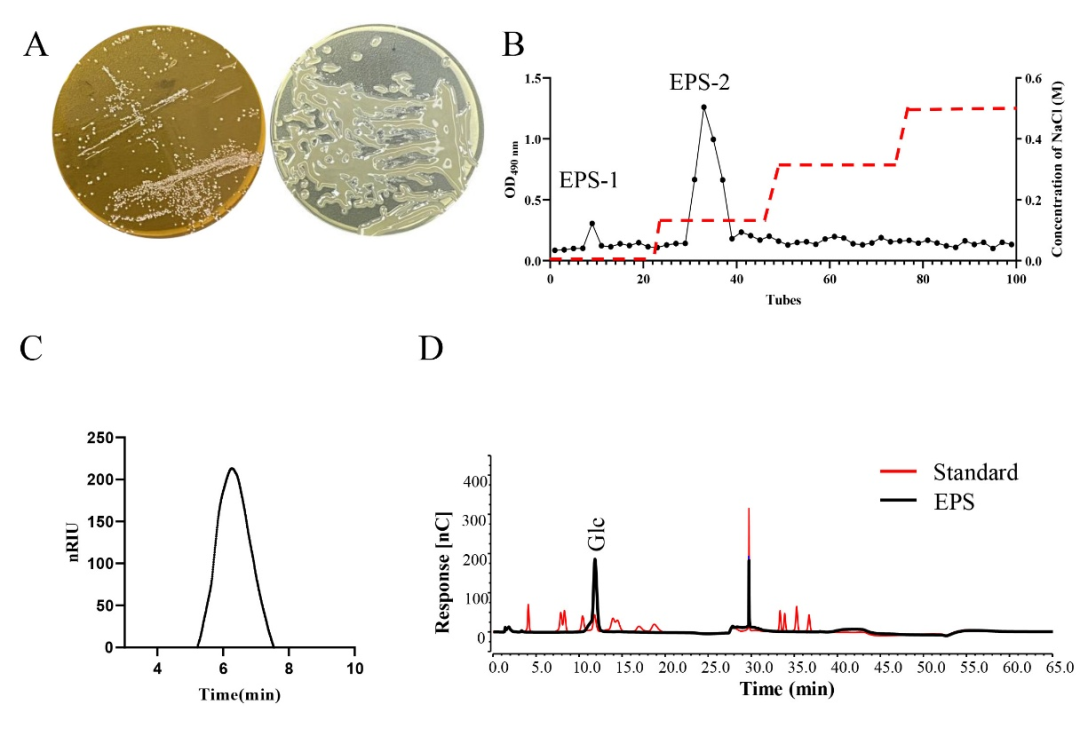
图1 EPS-2的纯化与组成分析
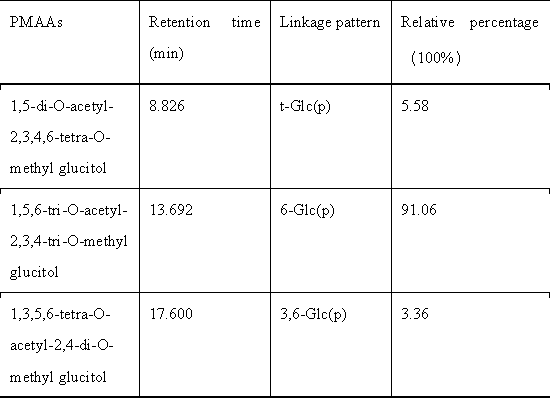
甲基化结果表明EPS-2是由葡萄糖组成,与EPS-2的单糖成分分析结果一致。分析结果显示EPS - 2中有三种不同的衍生物。单糖残基主要为线性的→6)-Glcp-(1→(占比91.06%),还存在一些末端的T-Glcp-(1→(占比5.58%)和分支的→3,6)-Glcp-(1→(占比3.36%)。
表1 EPS-2中糖残基的连接模式及相应的百分比含量
一维核磁和二维核磁分析信息,推断出该多糖主要是由→6)-α-D-Glcp-(1→和少量→3,6)-α-D-Glcp-(1→相互连接形成主链,支链主由α-D-Glcp-(1→连接在糖残基→3,6)-α-D-Glcp-(1→的O-3位置。

图2 EPS-2的NMR光谱和结构式
2.EPS-2改善DSS诱导的结肠炎小鼠肠道粘膜屏障功能损伤
本研究进一步以DSS诱导的小鼠溃疡性结肠炎(UC)为模型,探究EPS-2对肠道黏膜屏障的保护作用。结果表明EPS-2有效缓解了UC小鼠体重减轻、疾病活动指数(DAI)升高,结肠缩短和脾肿大现象。HE结果也表明,EPS-2干预后,DSS诱导小鼠的肠道上皮结构也得到显著改善。综上所述,EPS-2能够有效减轻DSS诱导的小鼠结肠损伤,展现出其在保护肠粘膜屏障方面的潜力。(图3)
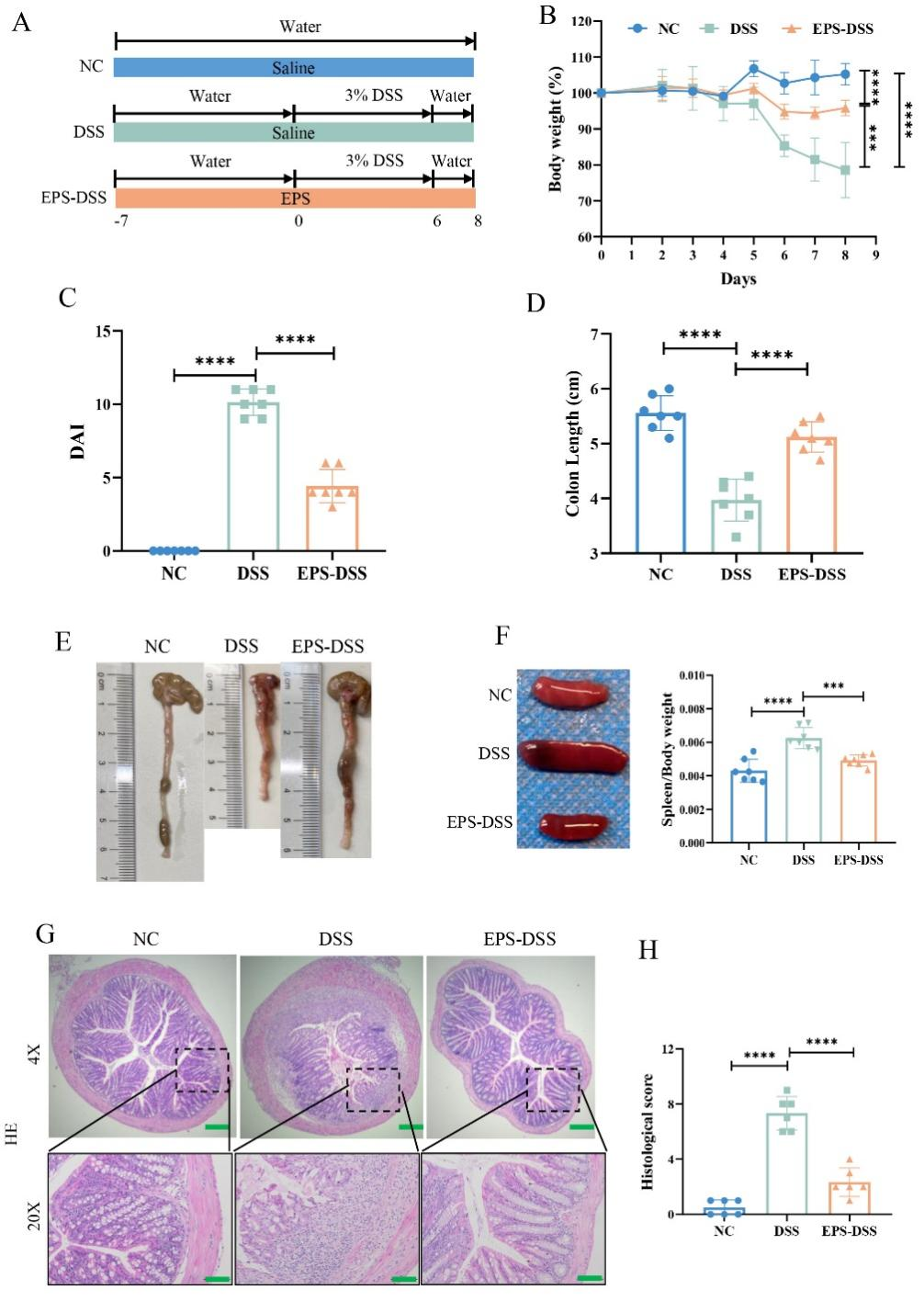
图3 EPS-2减轻DSS诱导的结肠炎小鼠的肠损伤症状
黏液层和分泌黏液的杯状细胞在维持肠道黏膜屏障的完整性和功能中发挥着至关重要的作用。杯状细胞可以分泌黏蛋白mucin-2,维持黏液层的功能,保护肠道屏障的完整性。经EPS-2处理后,UC小鼠的结肠中杯状细胞数量显著增加,功能得以改善,MUC-2分泌量增加,进而促使粘液层变得更加厚实。综上所述,EPS-2展现出了增强UC小鼠肠道黏膜屏障功能的效果。
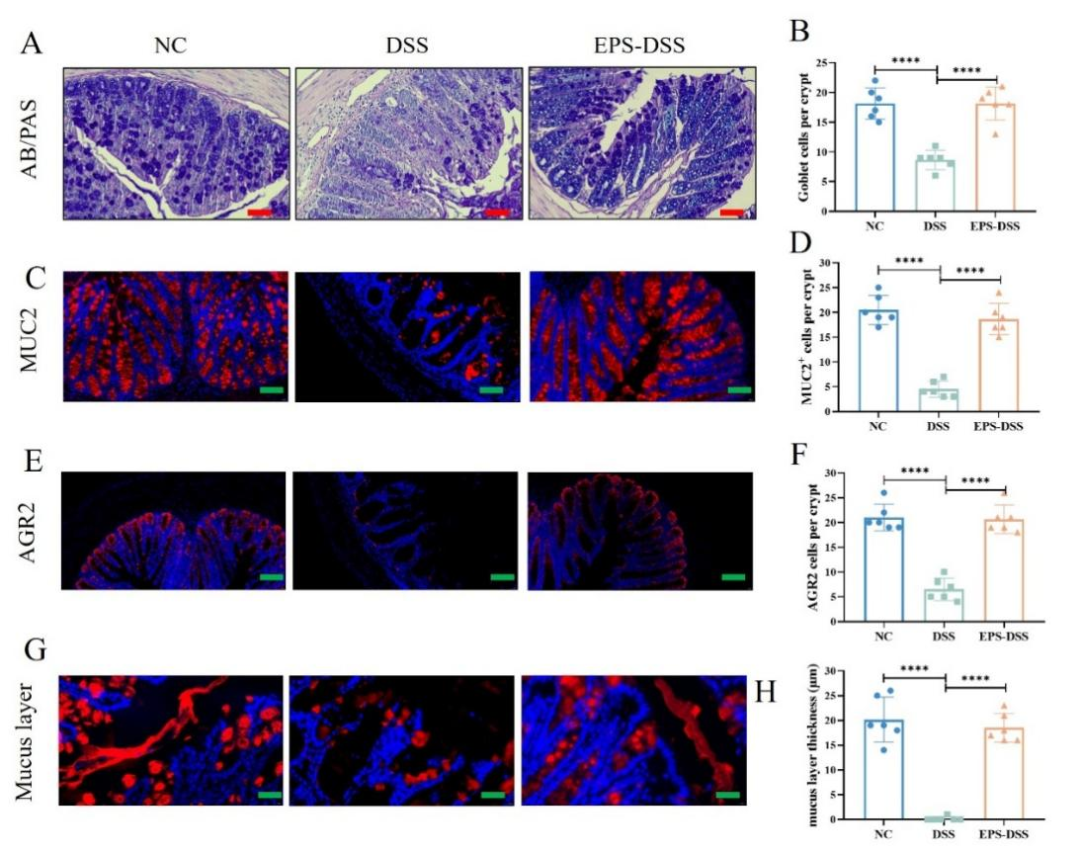
图4 EPS-2改善结肠炎小鼠的肠道黏膜屏障稳态
3.EPS-2保护肠道黏膜屏障的功能依赖于肠道微生物及其代谢产物丙酸
本研究结果显示,在经过EPS-2的处理后,UC小鼠的肠道微生物群多样性得到了显著改善。在门水平上,结肠炎小鼠中Proteobacteria和Campylobacterota的丰度更高,而Bacteroidota和Fusobacteriota相对丰度则降低。然而,EPS-2的干预有效增加了Bacteroidota的水平,并降低了Proteobacteria的比例。在属水平上,UC小鼠中抗炎菌Muribaculaceae和Alloprevotella水平显著下降,而产LPS的促炎菌Escherichia-Shigella和Helicobacter的丰度增加。EPS-2干预提高了Muribaculaceae的水平,并有效降低了Escherichia-Shigella的比例。该部分结果说明EPS-2改善了UC小鼠肠道菌群紊乱的现象。
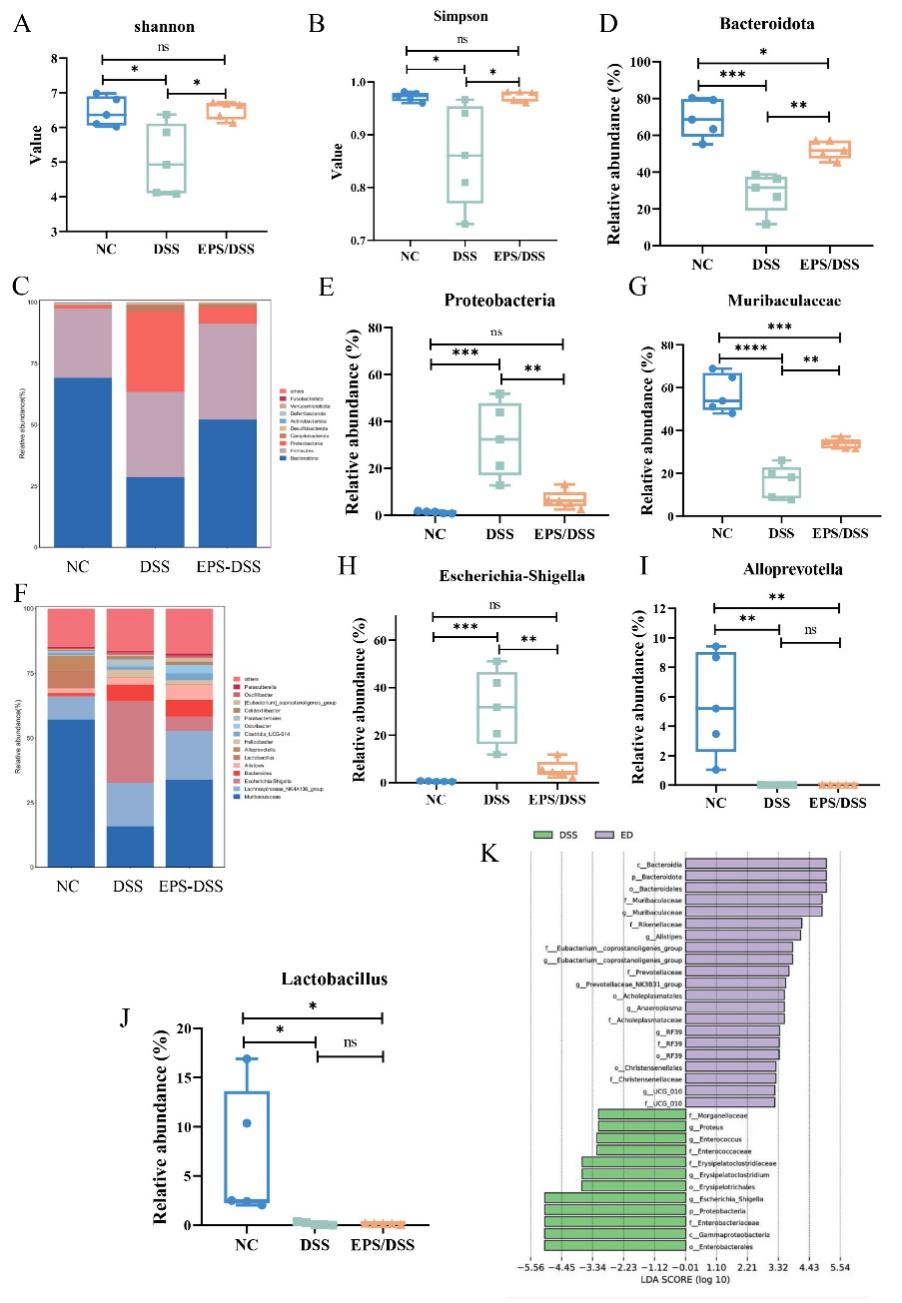
图5 EPS-2调节UC小鼠肠道微生物
Muribaculaceae具备将多糖发酵为短链脂肪酸的能力,对维护肠道健康至关重要。短链脂肪酸靶向代谢组分析表明EPS-2处理显著促进了UC小鼠结肠中丙酸水平的恢复。相关性分析也表明Muribaculaceae与丙酸盐含量呈正相关,而Escherichia-Shigella和Helicobacter则与丙酸盐含量呈负相关。经抗生素处理清除肠道微生物后,EPS-2对结肠炎小鼠肠粘膜的保护作用消失,暗示了肠道微生物在EPS-2保护肠道黏膜屏障中起到关键作用。丙酸盐的干预则促进了杯状细胞的增殖,并提升了MUC-2的表达水平,有效改善了黏液屏障的功能。综上所述,EPS-2并不直接增强肠粘膜屏障的功能,而是通过调节肠道微生物Muribaculaceae及其代谢产物丙酸的水平,间接地介导其保护作用。
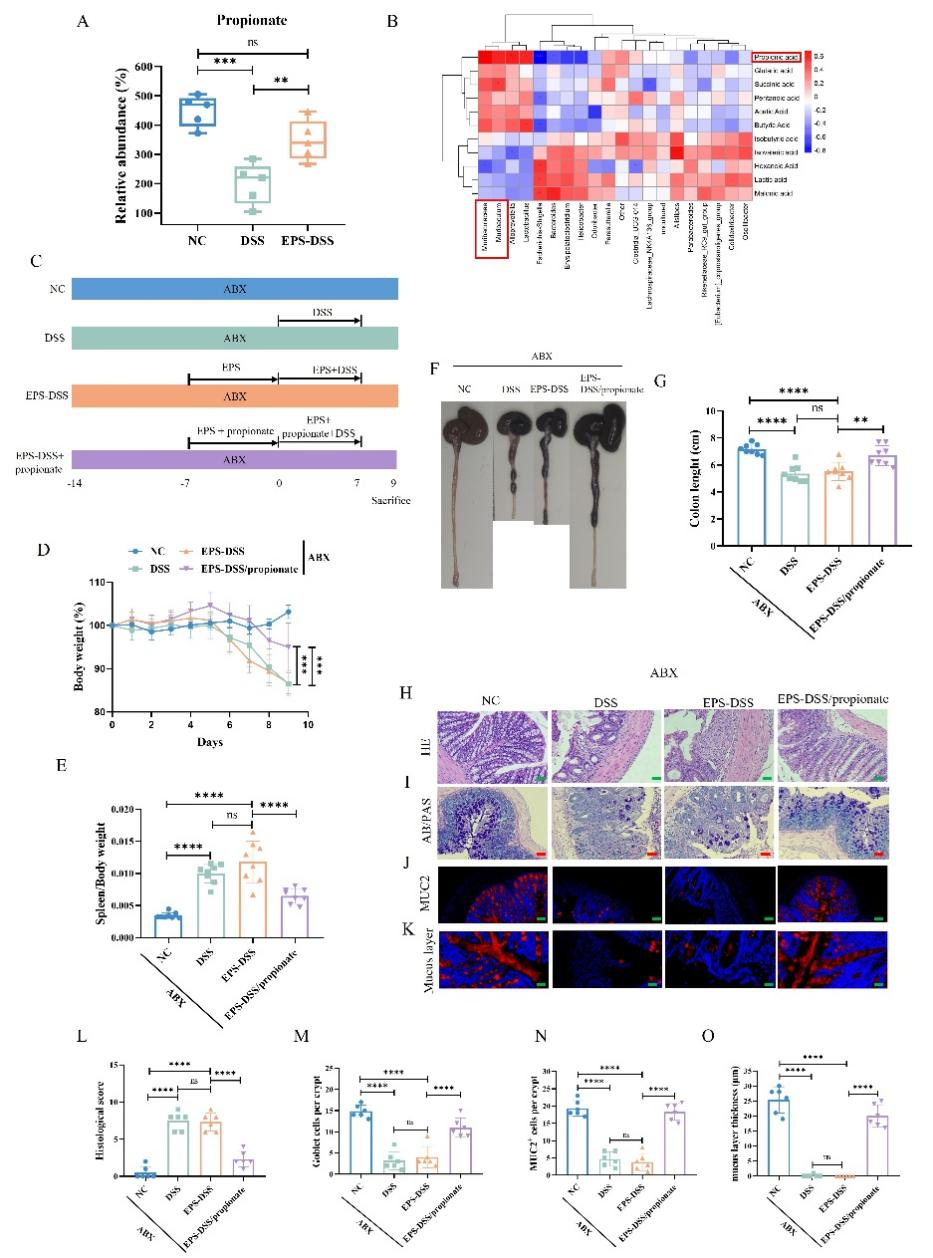
图6 EPS-2对肠黏膜屏障的保护作用依赖于肠道微生物和丙酸
4.EPS-2增强了肠上皮屏障的稳态
TUNEL染色结果显示,DSS组小鼠的TUNEL阳性细胞数量显著增多,预示DSS诱导了肠上皮细胞的凋亡。EPS-02处理后则能明显减少TUNEL阳性细胞的数量。此外,EPS-2也改善了肠道上皮屏障中紧密连接蛋白(Claudin-1和Occludin)的分布和表达。DSS导致结肠组织促炎和氧化应激水平增高,EPS-2干预后则缓解了结肠组织的炎症和氧化应激水平。肠道黏膜屏障完整性的破坏,会促进LPS经肠屏障进入内循环,EPS-2通过降低肠道黏膜屏障的通透性,显著内循环中LPS的水平从而减轻了系统性炎症反应。
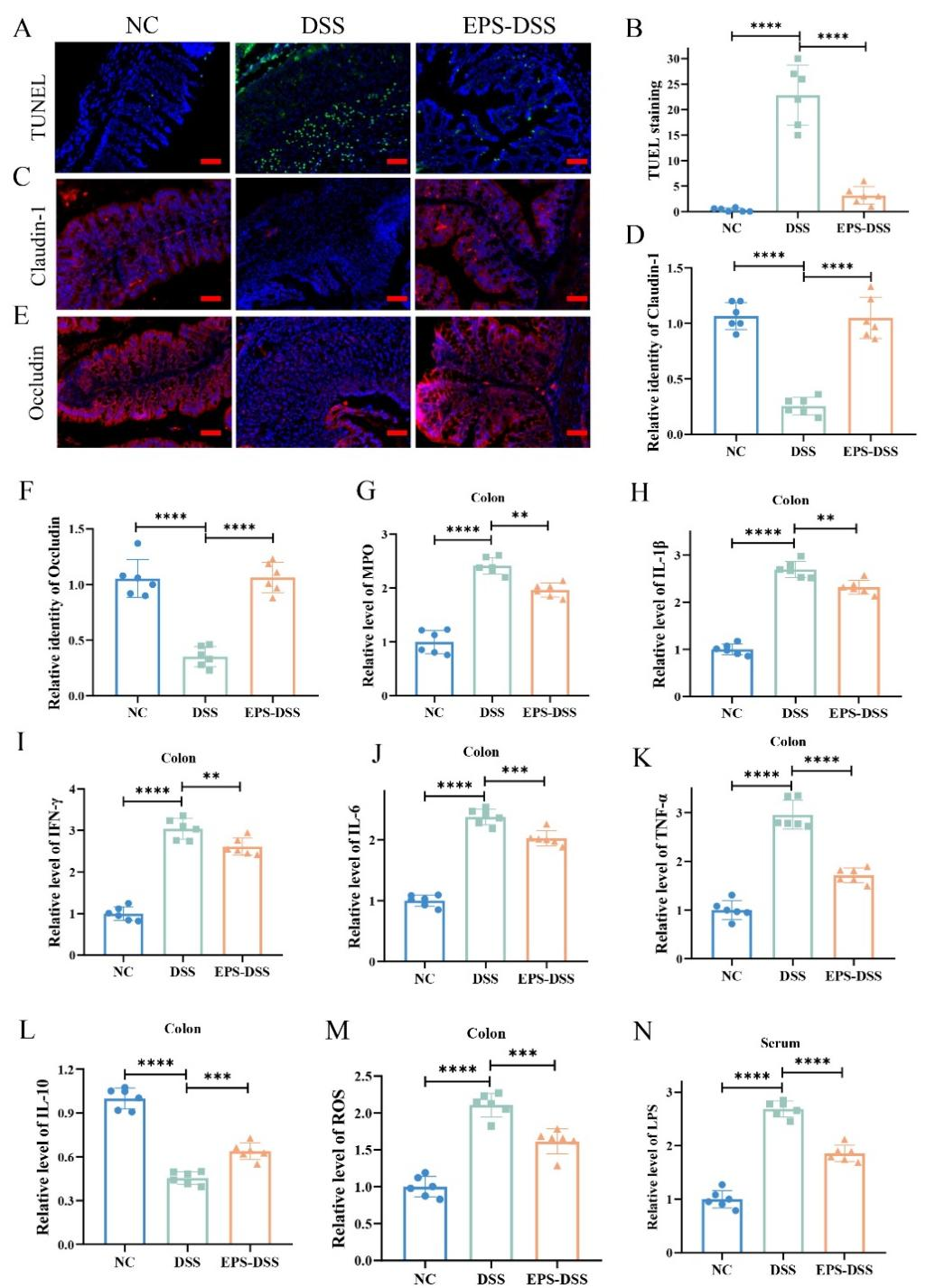
图7 EPS-2缓解UC小鼠肠道上皮屏障紊乱和炎症水平
5.EPS-2的生物安全性分析
细胞实验评估了EPS-2对正常上皮细胞系NCM460无显著毒性。此外,在连续灌胃给药一个月后,EPS-2处理组与对照组小鼠的体重无明显差异。进一步的生化分析显示,EPS-2给药后肝肾功能未见异常。HE染色结果显示,EPS-2处理组与对照组小鼠的主要器官无明显组织学差异。综上所述,口服EPS-2具有较好的安全性。
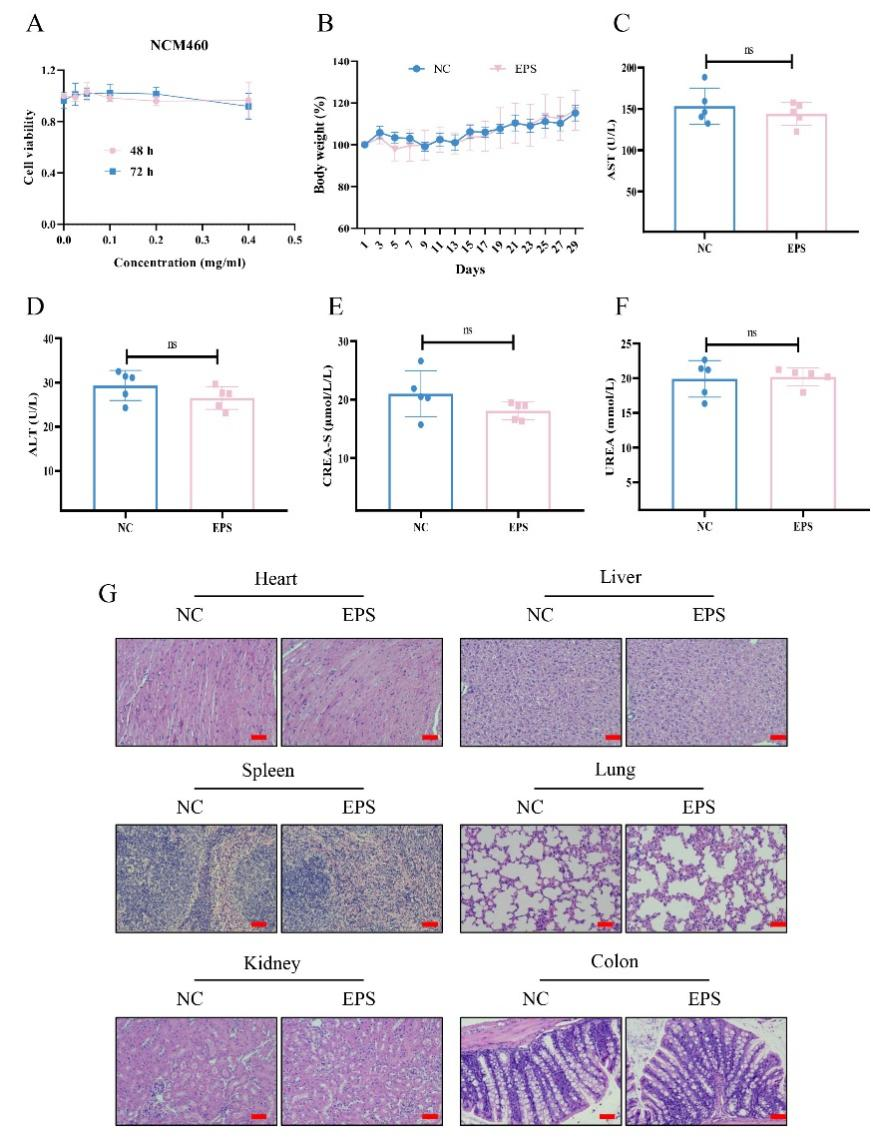
图8 EPS-2安全性验证
本研究利用从健康婴幼儿粪便中筛选得到的W.cibaria ZMC030,验证了其EPS产量以及结构表征。发现源自菌株ZMC030的EPS-2是一种新型右旋糖酐。EPS-2通过依赖于肠道微生物及其代谢产物丙酸的方式,保护肠道黏膜屏障功能的稳态。本研究证明EPS-2可作为一种新的后生元,具有应用于防治与肠道黏膜屏障功能紊乱相关疾病(如炎症性肠病IBD)的潜力。
滑动查看更多:
排版:野凌
审核:三黍生物企宣部




