文献解读
文献解读|Cell Research 系统代谢组学开拓三阴性乳腺癌精准治疗新视角
新陈代谢重编码是癌症的一个标志。然而,目前仍然缺乏对三阴性乳腺癌(TNBC)代谢物的系统描述。本篇文章研究分析了330个TNBC样本和149对正常乳腺组织的代谢组和脂质组,构建了完整的TNBC代谢组图谱。结合之前建立的同一队列的转录组和基因组,作者进行了TNBC代谢组和基因组学的综合分析。该研究将TNBC分为三个不同的代谢组学亚型:C1,以富含神经酰胺和脂肪酸为特征;C2,氧化反应和糖基转移相关代谢产物表达上调;C3,最低的代谢水平失调。基于这个新开发的代谢组数据集,作者对之前的TNBC转录组亚型进行了提炼,并确定了一些关键的亚型特异性代谢物以作为潜在的治疗靶点。转录组雄激素受体(LAR)亚型与代谢组C1亚型重叠。对患者来源的类器官和异种移植模型的实验表明,针对神经酰胺途径的中间体鞘氨醇-1-磷酸(S1P),是一种很有前途的治疗LAR肿瘤的方法。此外,转录组基础细胞样免疫抑制(BLIS)亚型包含两个预后代谢组亚群(C2和C3),可以通过机器学习方法进行区分。作者发现n -乙酰天冬氨酸是一种重要的促肿瘤代谢物,也是高危BLIS肿瘤的潜在治疗靶点。总之,该研究揭示了TNBC代谢组学的临床意义,不仅可以优化转录组分型系统,还可以提出新的治疗靶点。本代谢组学数据集可作为促进TNBC精准治疗的有用公共资源。
该论文于2022年2月1日,由复旦大学附属肿瘤医院乳腺外科邵志敏教授、江一舟教授领衔团队在 Cell Research(IF25.617)期刊发表,其题目为Comprehensive metabolomics expands precision medicine for triple-negative breast cancer 。

研究材料
330个TNBC样本和149个匹配的正常组织样本
技术方法
代谢组学,转录组学等
研究结果
TNBC的代谢组学和脂质组学分析
该研究表明,TNBC可分为三个代谢基因亚型,且对脂质代谢和糖酵解具有明显的依赖性。作者对330个TNBC样本的代谢组和脂质组进行了分析,以揭示代谢物整体变化规律。作者还将代谢组学与先前建立的基因组和转录组数据相结合,以探索TNBC的潜在代谢靶点,特别是转录组学的BLIS和LAR肿瘤。作者总共注释了594个代谢物以及1944个脂质分子。同时在330个样本中,作者得到了其中的258个样本的转录组数据。这些共同构成了一个巨大的TNBC的数据集。
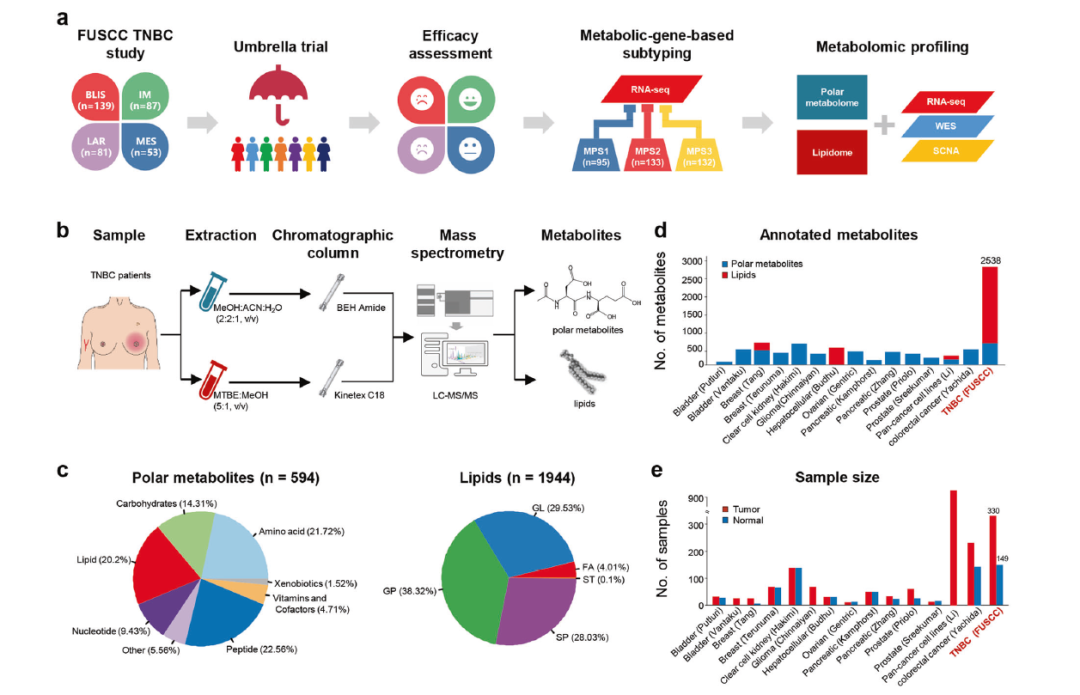
TNBC的代谢组学图谱
作者对三阴性乳腺癌的代谢组学进行了研究。通过火山图描述了594个注释过的代谢物和1944个脂质。并且对不同种类的代谢物分别进行分类编码。通过从代谢组学层面将TNBC分为三个不同的代谢亚组:C1,以神经酰胺和脂肪酸的富集为特征;C2,具有与氧化反应和糖基转移相关的代谢产物的上调;而C3则是代谢失调程度最低的。

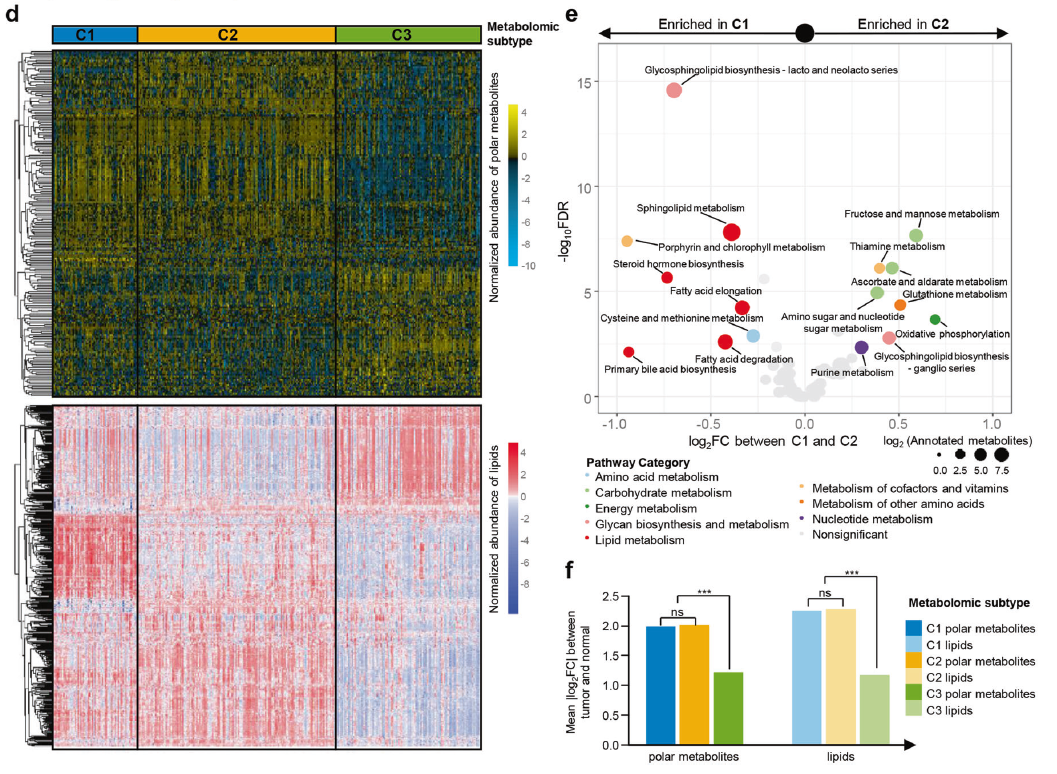
联系多组学特征进行综合分析
作者还探索了代谢组学和基因组特征之间的联系,以推测潜在的基因组驱动因素,其如何促进代谢组学特征的形成。最终作者发现了少数代谢物与其配对的代谢基因,如D-甘露糖以及MAN1A1具有显著相关性,此外作者发现PIK3CA突变与FA丰度正相关,而与GSSG丰度负相关,而BUB1B mRNA表达与s -腺苷蛋氨酸丰度正相关。另外研究表明,染色体12p13.33区域的拷贝数与神经递质-氨基丁酸(GABA)和n -乙酰天冬氨酸(N-acetyl-aspartyl-glutamate, NAAG)的丰度呈正相关(图3f)。综上所述,基因组特征与代谢物相关性的分析可能为研究TNBC代谢重编程的驱动力提供线索。
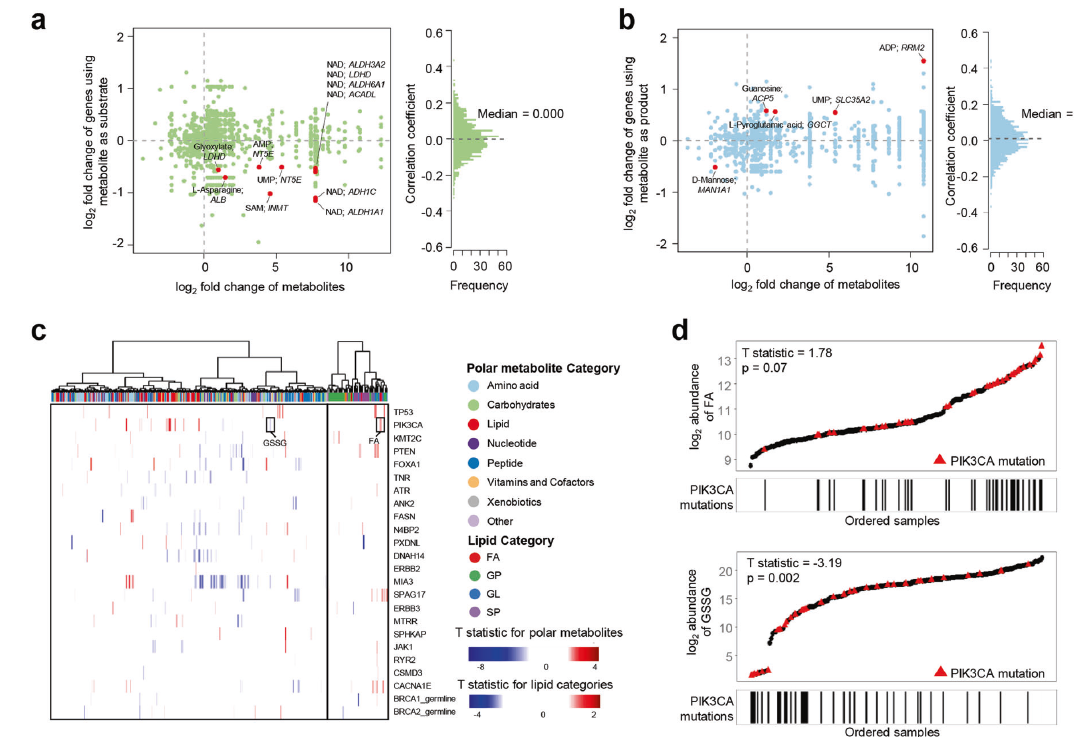
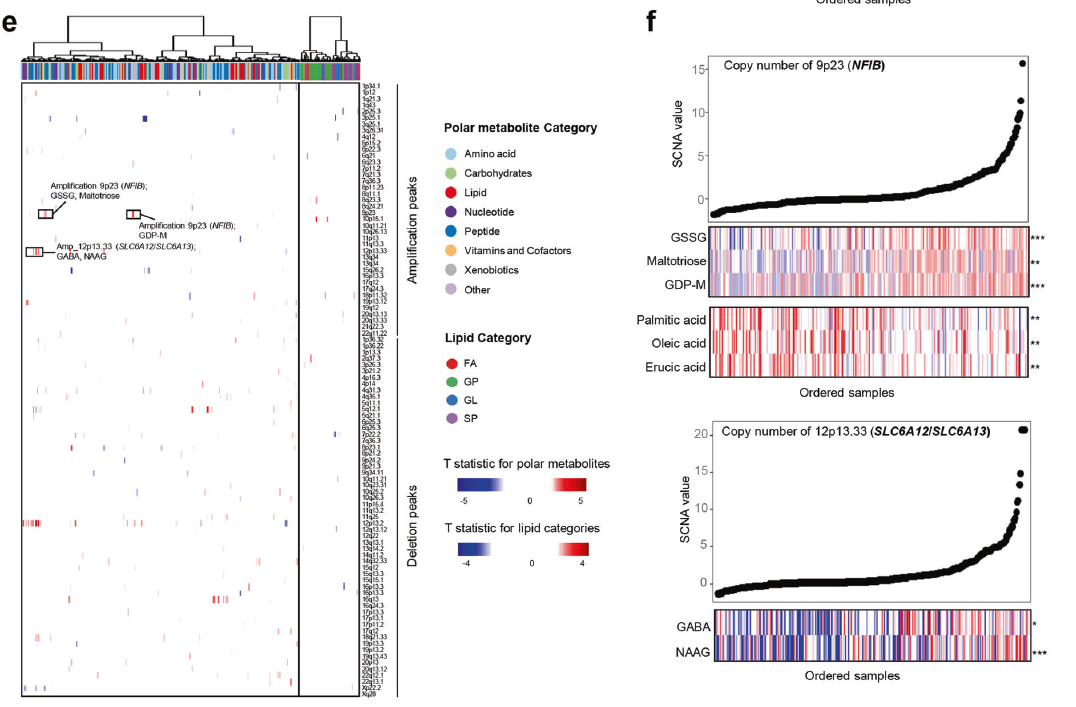
机器学习帮助通过代谢组学实现转录组学亚型的细化
作者进一步探讨了代谢组学亚型之间的联系,先前定义的转录组亚型4和基于代谢通路的亚型(MPSs)在转录组亚型上,LAR亚型几乎与代谢组C1亚型重叠;BLIS、免疫调节(IM)和间充质样(MES)亚型主要分为代谢组学C2和C3亚型。总之,代谢组学分析完善了之前研究的TNBC转录组亚型。考虑到作者所谓的FUTURE试验对LAR和BLIS患者的治疗效果不理想,代谢组学亚型5分型与转录组学亚型分型的整合需要进一步研究。对于LAR肿瘤,可以根据代谢组学C1亚型的特点,进一步探索代谢靶点。对于BLIS患者,简化的基于机器学习的代谢组学亚型系统可能会将他们划分为具有明显复发风险的组。
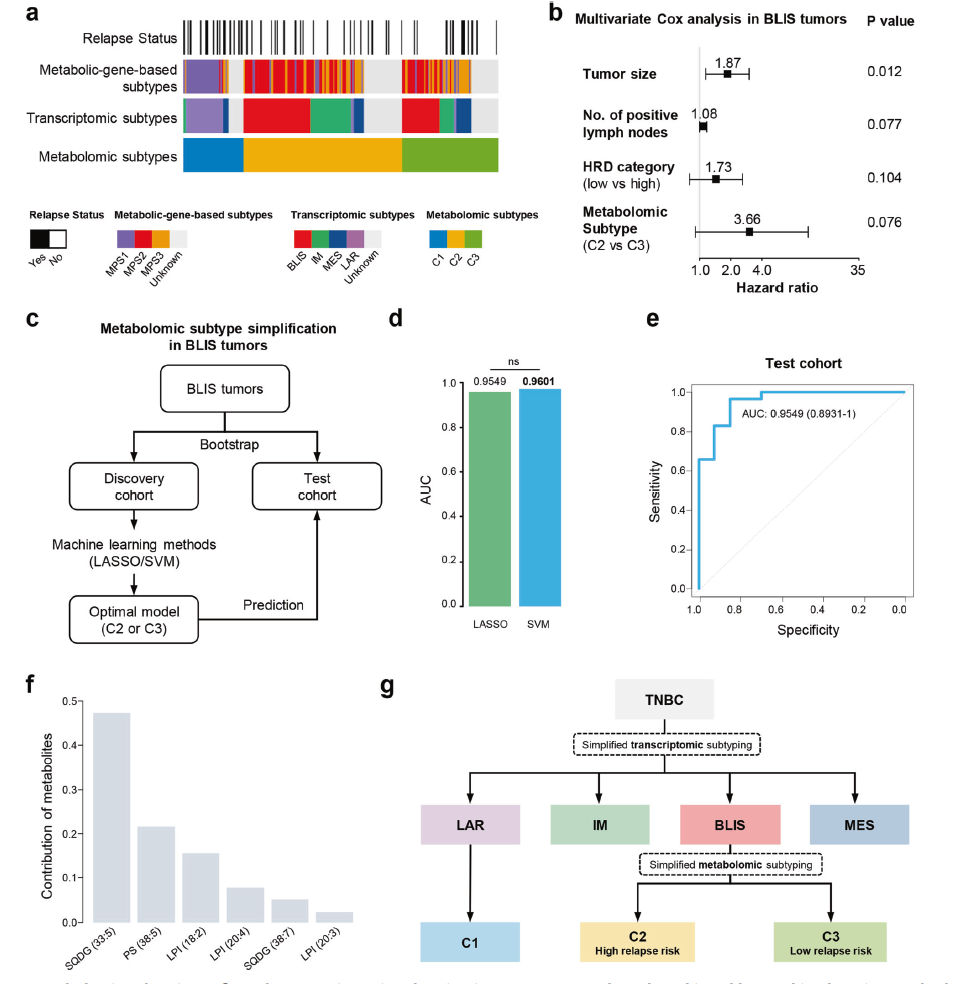
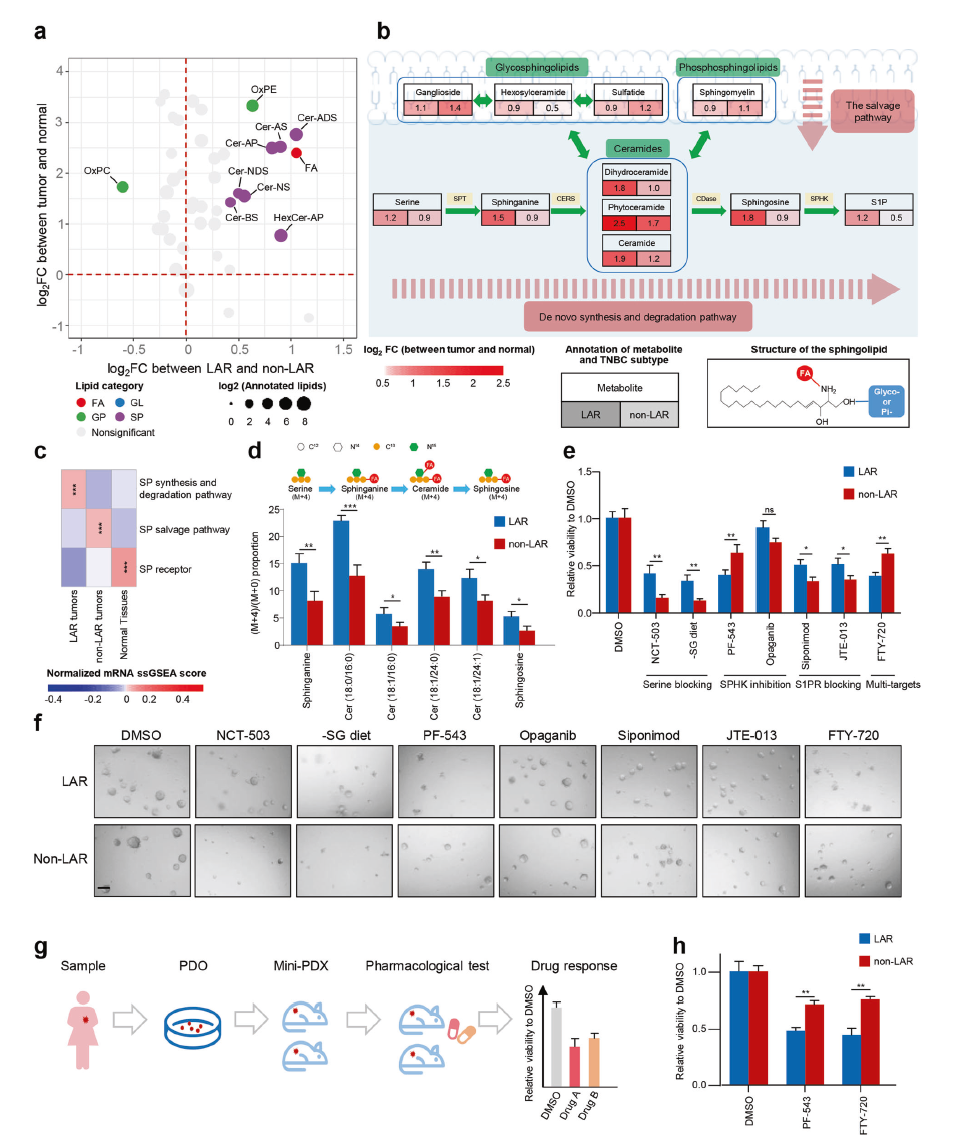
进一步研究发现,神经酰胺途径的重要中间体S1P在LAR肿瘤中发挥了重要作用。PF-543和FTY-720可能可以特异性治疗LAR肿瘤。
NAAG是BLIS肿瘤中重要的促瘤代谢物
作者进一步探索了BLIS肿瘤中重要的促肿瘤代谢物。在分析了在BLIS肿瘤中特异上调且预测预后不良的代谢物后,作者确定NAAG是一个潜在的候选代谢物,通过研究发现NAAG是BLIS肿瘤中重要的促肿瘤代谢物,靶向NAAG的生物合成可能是一种可行的治疗BLIS肿瘤的策略。
总结
该研究 成功绘制出当前世界上最大规模的三阴性乳腺癌代谢物图谱 ,优化了既往分型标准,为三阴性乳腺癌的精准个体化治疗提供新方向 ;作为三阴性乳腺癌“复旦分型”研究的延续,研究团队还针对目前疗效最差的两个三阴性乳腺癌亚型,提出对代谢通路中的关键代谢物鞘氨醇-1-磷酸和N-乙酰-天冬-谷氨酸的合成进行抑制,有望成为此类乳腺癌的精准靶向治疗的潜在策略。
项目推荐




