文献解读
文献解读|肝肠轴新发现—枸杞多糖能够预防非酒精性脂肪肝

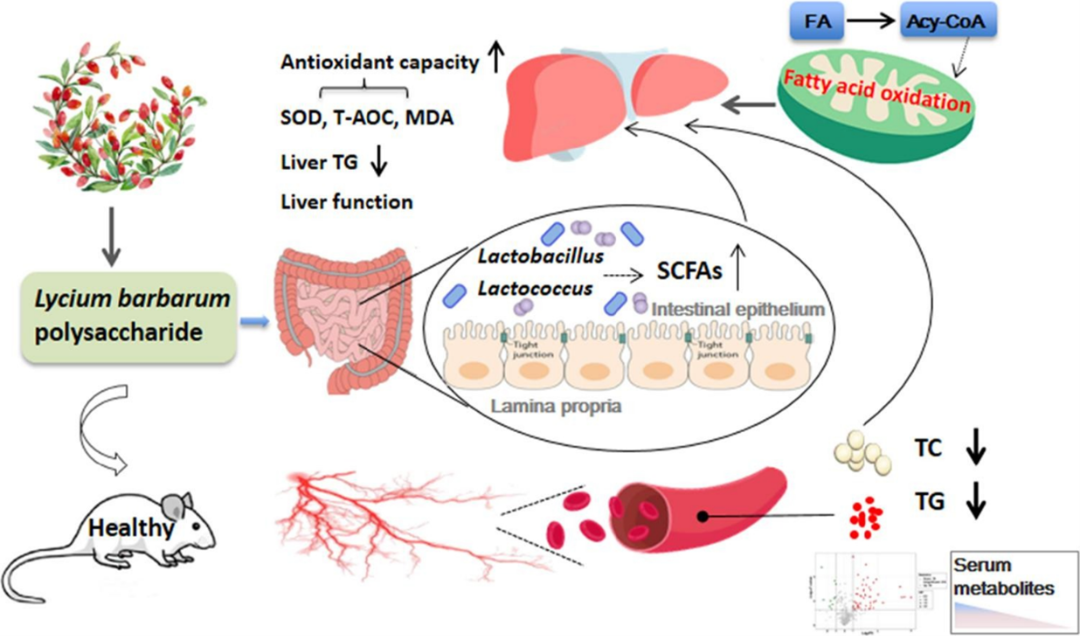
肠道也被称为人类的第二大脑,其原因是肠道菌群能够通过多种方式影响宿主的健康情况。有大量证据表明,食用多糖可以维持健康的肠道微生物种群,降低系统性炎症,增强肠道屏障功能和预防疾病等。枸杞多糖是枸杞果实中的主要生物活性成分,具有相当的健康促进作用。
2023年3月发表在Food Research International上的题为“Serum metabolomics combined with 16S rRNA sequencing to reveal the effects of Lycium barbarum polysaccharide on host metabolism and gut microbiota”的文章,通过小鼠样本研究了枸杞多糖对宿主代谢反应和肠道微生物群的影响,提供了枸杞多糖对高脂血症和非酒精性脂肪肝的潜在预防作用的新证据。

实验小鼠被随机分为对照(NC),枸杞多糖(LBP)低剂量(100 mg/kg ,LBP-L)和高剂量(200 mg/kg ,LBP-H)三组。在四周的灌胃中,小鼠体重均有所上升,且组间无差异(图1A)。随后的生化分析中显示,与NC相比,LBP-H中的总胆固醇(TC),甘油三酯(TG)水平显著下降,低密度脂蛋白胆固醇(LDL-C)也有所下降,但不显著,三组之间的HDL-C水平没有差异(图1B-E)。这些结果表明,LBP能有效地预防高脂血症和脂肪肝。
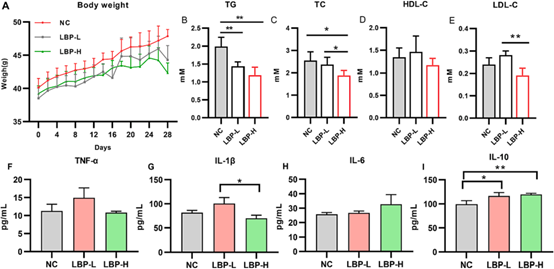
图1 LBP对小鼠体重、血脂及血清细胞因子的影响
肝脏氧化应激不仅是肝脏损伤的病理生理基础,而且还参与其他疾病的发病机制。为了研究不同剂量LBP对小鼠肝脏抗氧化能力的影响,作者测定了肝脏中总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-PX)的水平。表征肝损伤严重程度的丙氨酸氨基转移酶(ALT)和总胆酸(TBA)在各组间并无显著差异,证明小鼠的肝脏代谢功能相对良好,属于健康状态(图2A-B)。氧化应激相关结果显示,高剂量的LBP显著提升了肝脏的T-AOC和SOD水平,降低了MDA和TG水平,而CAT和GSH-PX并无显著变化(图2C-H)。
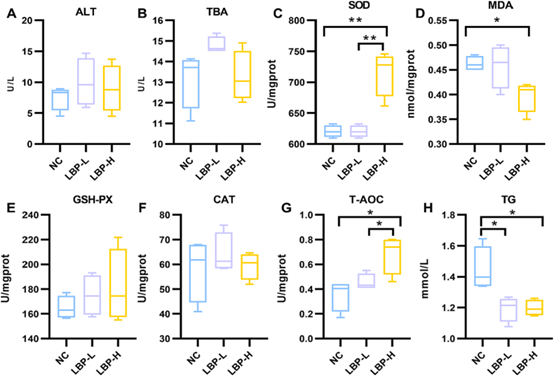
图2 LBP对肝脏的影响
随后,作者通过病理切片确认LBP对肝脏和结肠的影响,如图3所示,LBP处理对组织微观结构并无显著影响。在所有组别中,肝细胞围绕中心静脉呈放射状排列,肝细胞之间的界限明显。肝细胞的细胞质中没有脂质滴。结肠染色结果显示,三组的结肠各层组织结构排列整齐,粘膜上皮完整,无明显炎症细胞浸润。

图3 LBP对肝脏和结肠组织结构的影响
大量证据表明,肠道微生物对宿主健康有深远的影响,因此作者检测了不同分组中的粪便微生物特性。分析结果表明,所有组别的α-多样性指数并没有显著变化,这表明LBP对小鼠肠道微生物群的多样性和丰富性干扰不大,β-多样性的结果显示,LBP引起了小鼠肠道微生物群落结构的变化(图4A-B)。
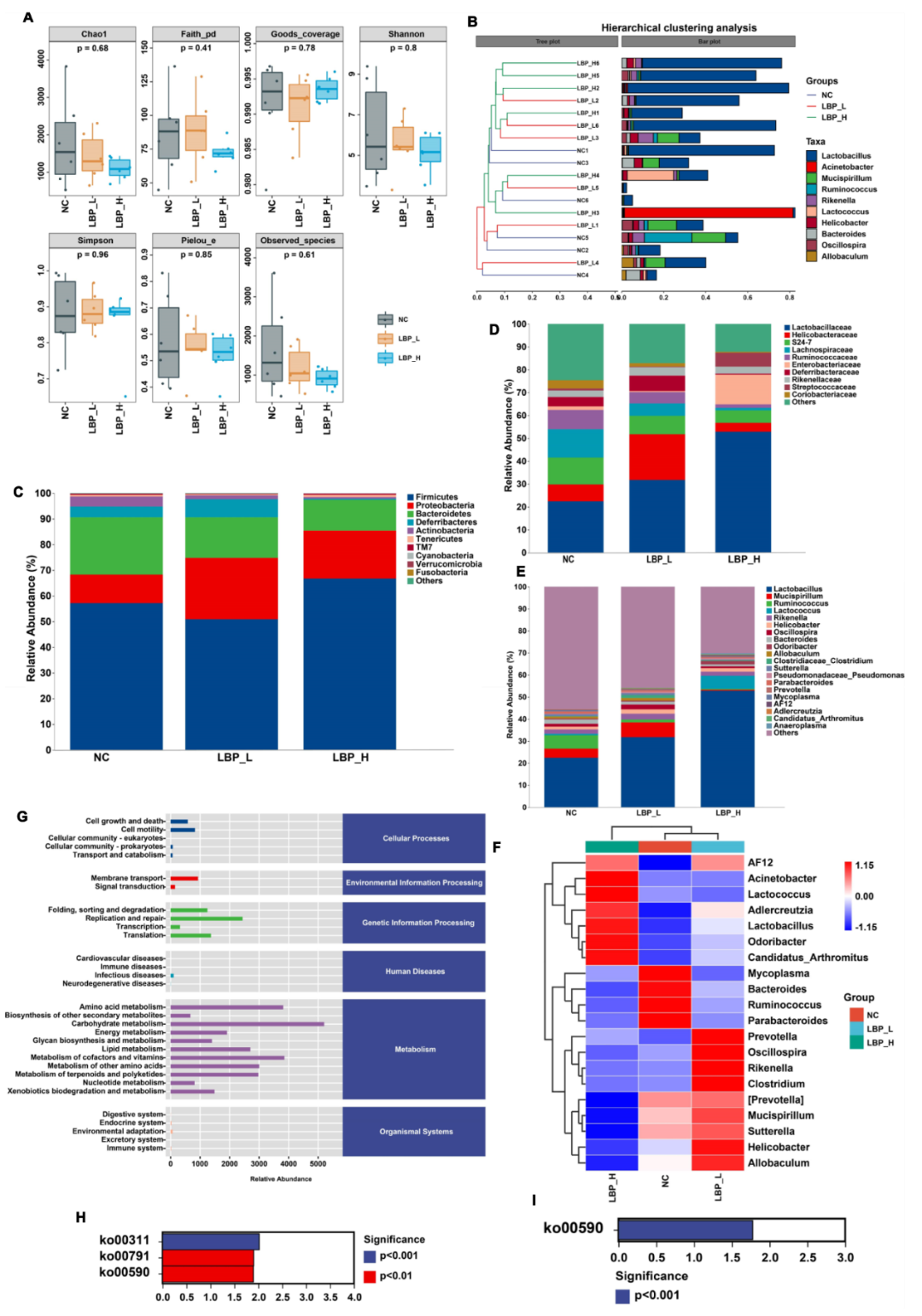
图4 LBP对粪便微生物群落结构和功能的影响
如图所示,所有分组的主要SCFAs包括乙酸盐、丙酸盐和丁酸盐。粪便中(图5A-L)LBP-H组的总SCFAs浓度达到52.18 μmol/g,明显高于NC组(39.69 μmol/g)。尽管NC组和LBP组之间单个SCFAs的差异没有统计学意义,但在LBP-H组中检测到较高的乙酸盐水平,是NC组的1.32倍。结肠内容物中SCFAs的分布与粪便中相似,如图5G-L所示,与NC组相比,LBP处理组的总SCFAs水平明显更高。与NC组相比,两种剂量的LBP都能选择性地增加结肠内容物中的乙酸盐浓度。在结肠内容物中,除乙酸盐外,所有SCFAs在NC组和LBP组之间没有明显差异。此外,结肠内容物中的SCFAs总量比粪便中的高约1.42倍。
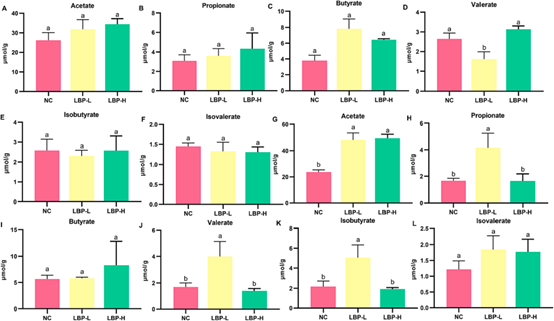
图5 LBP对粪便和结肠内容物的短链脂肪酸浓度的影响
代谢组正离子模式分析显示,NC组与LBP-H组在代谢物成份上有显著区别(图6A-B),在VIP>1.0,P < 0.05 和 FC>2 或FC<0.5的筛选标准下,有64种代谢物(54种上调,10种下调)在NC组和LBP-H组之间的丰度存在明显差异,主要分为甘油磷脂、甘油脂、生物碱、酯类和醛类(图6C-F)。通过KEGG途径富集分析,作者观察到脂肪酸降解途径在LBP-H组中被富集(图7G)。
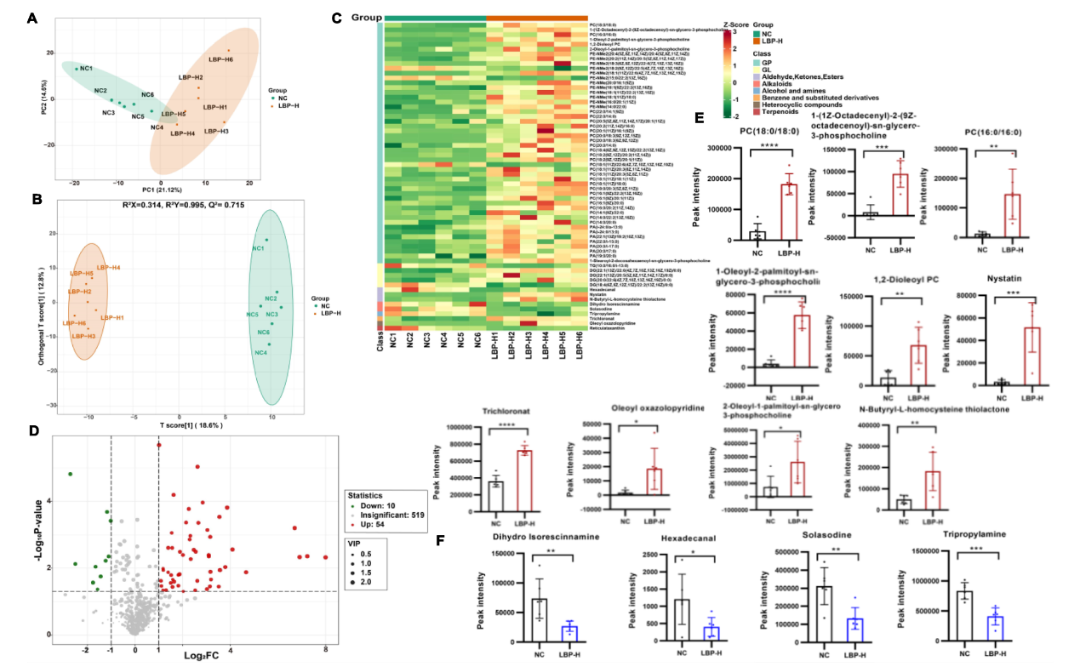
图6 高剂量LBP对血清ESI(+)代谢物的影响
负离子模式下也显示出了NC组和LBP-H组之间的明显差异(图7A-B),在相同的筛选条件下得到了7个差异性的代谢物(3个上调,4个下调),其中,4-氯-2-甲基苯酚、PC(18:1(9Z)/18:1(9Z))和PC(18:0/16:1(9Z))的丰度明显上调,而三氯乙酸、乙酸、美兰普林和8-脱氧甘氨酸则表示出下降趋势(图7C-F)。多种代谢物与15条代谢途径密切相关(图7H),其中丙酮酸代谢、磷酸盐和磷酸盐代谢、糖酵解/葡萄糖生成等途径的丰度系数较高,其次是丙酸盐代谢。除此之外,尽管差异代谢物在区分NC组和LBP-H组样品方面表现良好,但只有三氯乙酸和乙酸参与了代谢途径的富集。
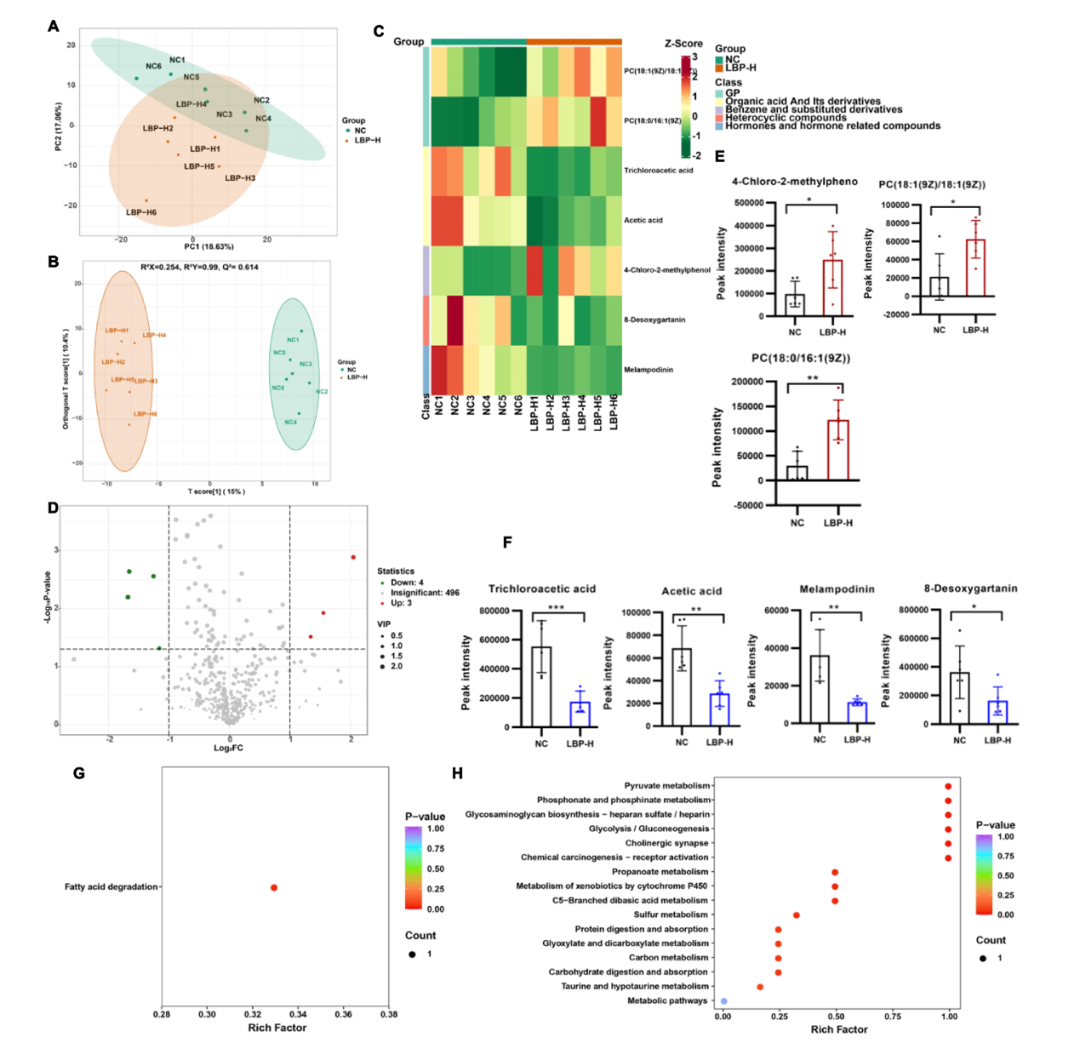
图7 高剂量LBP对血清ESI(-)代谢物的影响
基于脂肪酸降解途径在LBP-H组中被富集的结果,作者随后检测了肝脏脂质代谢相关基因的表达水平(图8)。在选定的关键基因中,PPARɑ、ACOX1和CPT-1α被LBP处理上调,LBP-L组中涉及脂质分泌/转运的基因CD36被上调,表明枸杞子对脂质分泌/转运可能有影响,参与脂肪生成的PPARγ的mRNA水平明显降低,证明脂质合成可能被影响。
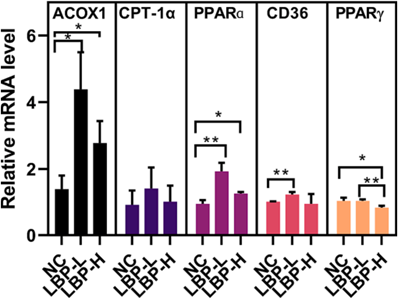
图8 LBP对脂质代谢相关基因转录的影响
为了确认LBP诱导的生化指标的改变是否与肠道菌群相关,作者进行了Spearman相关性分析(图9)。如图所示,乳酸菌丰度与SOD正相关,与血清LDL-C水平负相关,LBP-H组中丰度较低的乳球菌属与血清LDL-C呈正相关,肝脏TG与Allobaculum呈正相关,与AF12呈负相关,这些结果证明了菌群改变能够影响小鼠的生化及代谢表型。
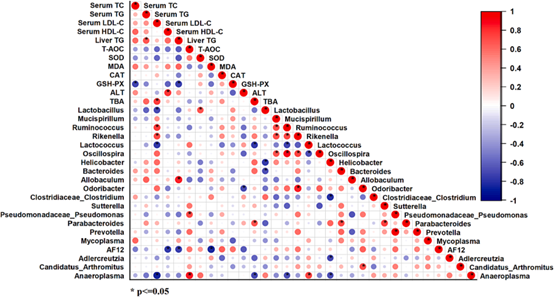
图9 肠道菌群与代谢表型之间相关性分析
在这篇研究中,作者通过分析LBP对宿主小鼠的代谢和粪便微生物群的影响,发现了LBP能够降低血清TC和TG的水平,促进IL-10的分泌,并改善肝脏的氧化应激,增加有益菌的丰度并促进SCFAs的产生,从而对小鼠体内包括脂肪酸降解途径在内的多种代谢通路产生影响。这些数据表明,LBP能够通过调节肠道微生物群的方式,预防小鼠非酒精性脂肪肝和相关代谢紊乱。

往期推荐
客户文章|Food&Function:生态环境对苜蓿多糖结构特性和生物活性的影响
Front Nutr 一作解读|添加天竺葵精油的木薯淀粉复合膜相关性能的研究
一作解读|Foods 火参果 (Cucumis metuliferus) 果皮中果胶的免疫活性和肠道微生物群调节
客户文章|Frontiers in Nutrition.一作解读:甘油和赤藓糖醇不同配比对玉米淀粉基薄膜性能的影响
客户文章|F.C.一作解读:微波加热制备淀粉-脂质复合物的研究
... ...

文本:牛晶晶
排版:檀檀
审核:三黍市场运营部



