文献解读
文献解读 |肝细胞癌一线药物耐药机制新发现

肝细胞癌(Hepatocellular carcinoma,HCC)是全世界癌症相关死亡的第三大原因,超过70%的HCC被诊断为晚期,治疗方案非常有限。索拉非尼和乐伐替尼是被批准的一线治疗药物,然而但大多数患者最终会出现乐伐替尼耐药。目前,既没有可靠的预测乐伐替尼治疗反应的生物标志物,也没有针对乐伐替尼耐药的药物,极大阻碍了HCC的系统治疗。
2023年1月发表在Cancer research上的题为“METTL1-Mediated m7G tRNA Modification Promotes Lenvatinib Resistance in Hepatocellular Carcinoma”的论文,通过对耐药HCC细胞株的蛋白质组检测和TRAC-seq,发现甲基转移酶样蛋白-1(METTL1)介导的m7G tRNA修饰在促进乐伐替尼耐药性方面有重要作用,这给未来的研究提供了一个希望的耐药性预测标记。
108名HCC患者
HCC细胞株
小鼠
蛋白质组学,Western Blot,Northern Blot,HE,免疫组化,RT-qPCR,TRAC-seq,多核糖体mRNA测序,动物实验


作者首先培养了三种乐伐替尼耐药HCC细胞系(Huh7-LR、PLC/PRF/5-LR和Hep3B-LR),结果表明,耐受细胞株的乐伐替尼敏感性较低,且与它亲代细胞相比,细胞形态上表现出拉长的纺锤形(图1A-C)。通过蛋白质组学检测后发现,相比于非耐药亲代细胞,两个关键的tRNA m7G甲基转移酶复合物成分(METTL1和WDR4)在耐药HCC细胞中显著上调,WB结果也证实了该结果,相对应的,耐药细胞中的tRNA m7G修饰水平也升高(图1D-E)。
随后,通过HCC患者的器官模型评估,作者发现大多数器官对乐伐替尼治疗表现出耐药性,而只有少数器官对仑伐替尼表现出敏感性(图1F-G),且对乐伐替尼耐药的HCC器官具有较高的METTL1和WDR4的表达水平(图1H),HCC患者队列的检测表面,耐药性患者体内METTL1和WDR4的表达也上调了(图1I)。与METTL1或WDR4表达水平高的患者相比,表达水平低的患者预后更好(图1J-M)。
上述结果证实了METTL1和WDR4可能在乐伐替尼耐药方面发挥重要作用。

图1 METTL1和m7G tRNA修饰在乐伐替尼耐药细胞中上调
为了进一步证实METTL1作用,作者构建了METTL1敲低Huh7-LR、PLC/PRF/5-LR、Hep3B-LR细胞株,敲低细胞对乐伐替尼的敏感性有所回复,导致增殖能力受损(图2B-C),存活克隆减少(图2D-E),凋亡比例增加(图2F-I)。为了研究METTL1是否通过tRNA m7G修饰来调节仑伐替尼的耐药性,作者在对乐伐替尼先天敏感的亲本Huh7细胞中过量表达了野生型METTL1和其催化无活性突变体,Northwestern blot结果表明,相比无活性突变体,野生型METTL1的过表达增加了tRNAs中的m7G修饰水平(图2J)、Huh7细胞对乐伐替尼的耐药性、殖能力(图2K)及存活的克隆数(图2L),同时减少了凋亡比例(图2M-N)。
上述结果表明, METTL1以酶活性依赖的方式促进了乐伐替尼耐药表型。
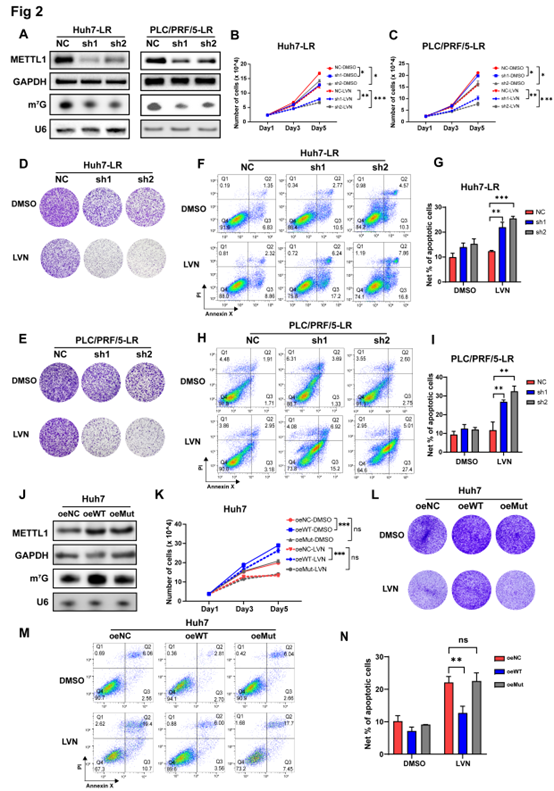
图2 METTL1通过酶促方式诱导肝癌细胞对乐伐替尼的耐药
TRAC-seq数据显示,乐伐替尼耐药细胞中共有15个tRNAs含有m7G修饰,已确定的m7G修饰的tRNAs的信号在耐药细胞中被上调(图3B),同时也观察到m7G修饰的tRNAs的表达水平增加(图3C-D)。由于tRNA是翻译必须的,作者随后检测了样本内蛋白翻译情况,普罗米辛摄取实验显示,耐药细胞中的全局蛋白新合成增加,并随着METTL1敲低而减少(图3E-F)。此外多核糖体分析也显示,两种乐伐替尼耐药细胞中多糖体峰值增加(图3G-H),进一步支持耐药细胞中全局mRNA翻译被上调的发现。且METTL1敲低后,峰值也被降低(图3I-J)。此外,过表达野生型METTL1而不是催化无活性的METTL1能促进全局蛋白新合成(图3K)。
这些数据表明乐伐替尼耐药细胞的全局mRNA翻译增加主要是由METTL1通过酶依赖方式介导的。
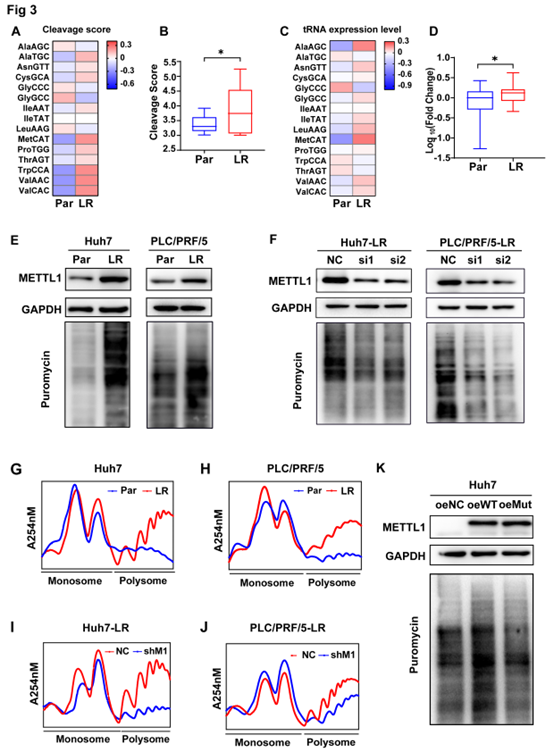
图3 METTL1是乐伐替尼耐药细胞中翻译活性上调所必需的
在乐瓦替尼耐药细胞中降低METTL1后,有3921个mRNA的翻译效率下降(图4A)。翻译效率降低的mRNA具有更高的m7G修饰的tRNA解码密码子的频率(图4B),表明METTL1介导的m7G tRNA修饰以密码子频率依赖的机制调节靶mRNA翻译。通过GSEA对翻译效率变低的mRNA进行通路富集情况后发现,表皮生长因子(EGFR)途径的编码序列(CDS)长度较长(图4D),与m7G相关的密码子较多(图4E),此外,在EGFR途径中翻译效率下降的mRNA中,EGFR mRNA具有最丰富的m7G相关密码子(图4F),进一步的qPCR实验证明,表皮生长因子受体mRNA的翻译效率在两种乐伐替尼耐药细胞中都是上调的(图4G-H)。后续实验结果显示,与亲代细胞相比,乐伐替尼耐药细胞中的EGFR mRNA从单体部分转移到多体部分(图4I-J),METTL1沉默时,EGFR mRNA的翻译效率下降(图4K-N),且乐伐替尼耐受细胞中的EGFR蛋白表达水平及其下游靶点的磷酸化水平被上调,但在METTL1敲低后则有所下降,活性实验表明是野生型METTL1在起作用(图4O-Q)。
上述数据表明,METTL1的缺失可以破坏EGFR的翻译,抑制耐药性相关途径的活性。

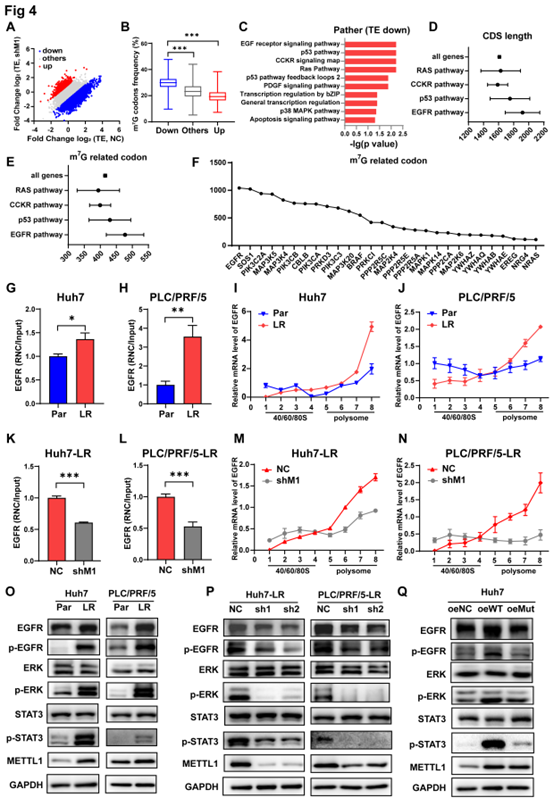
图4 METTL1促进EGFR的翻译效率
在METTL1抑制细胞中过表达EGFR后,耐药表型部分回复,表现为在乐伐替尼存在时提高细胞增殖能力和克隆能力(图5A-C),降低细胞凋亡比例(图5D-E)。与之相对应的是,在抑制METTL1过表达的细胞中的EGFR后,可部分挽救乐伐替尼的敏感性(图5F-J)。
上述结果表明, EGFR途径在METTL1介导的乐伐替尼耐药性中起着关键作用。
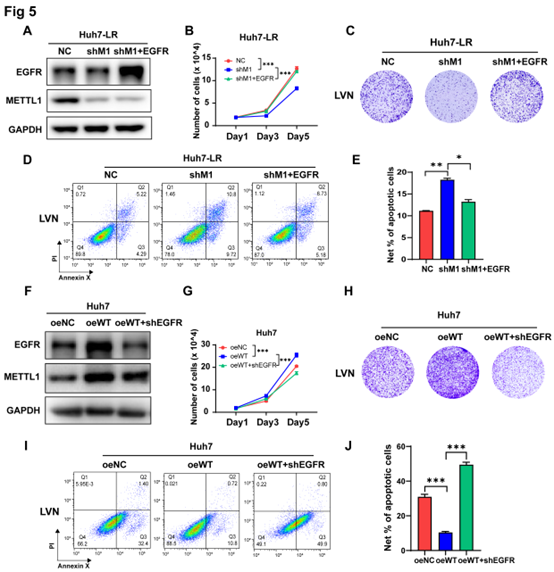
图5 METTLI介导的m7G tRNA修饰通过EGFR诱导乐伐替尼耐药性
为了验证METTL1在体内的作用,作者构建了肝癌发生模型,其中myr-AKT1和N-RasV12原癌基因被睡美人(Sleepy Beauty,SB)转座酶通过水动力转染稳定地整合到肝细胞的基因组中,诱导HCC肿瘤发生(图6A)。小鼠被分为4组,空载组(myr-AKT1/N-RasV12/空载体质粒/SB),有或没有乐伐替尼治疗;METTL1过表达组(myr-AKT1/N-RasV12/Mettl1/SB),有或没有乐伐替尼治疗。
空载组中,乐伐替尼治疗减少了肿瘤负担,表现为腹部大小(图6B)和肝脏肿瘤病灶(图6C)的减少,以及肝脏重量(图6D)和肝脏重量与体重的比率的降低(图6E),而在METTL1过表达组中,乐伐替尼并无显著作用。HE和IHC的检测结果也显示,在空载组中,乐伐替尼治疗导致肿瘤密度的降低,并伴随着较低的Ki67阳性细胞和EGFR表达水平,然而,METTL1过表达后,上述标志物在乐伐替尼治疗下保持不变(图6F-G)。
上述数据表明,METTL1在诱导体内乐伐替尼耐药性方面起关键作用。
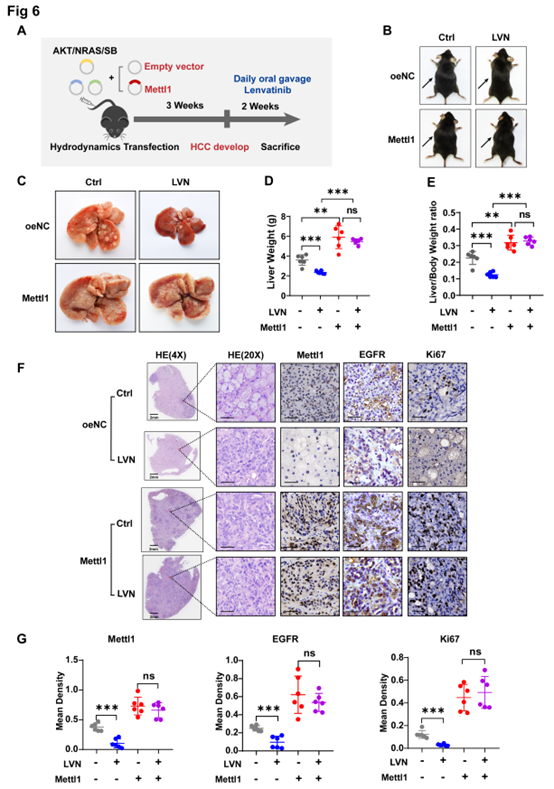
图6 METTL1的过表达促进乐伐替尼在体内的耐药
作者随后用METTL1敲低或乐伐替尼耐药的Huh7-LR细胞进行异种移植,肿瘤达到约100mm3后将小鼠分为四组:有或没有乐伐替尼治疗的对照组;有或没有乐伐替尼治疗的METTL1敲低组。数据显示,药物治疗对有乐伐替尼抗性细胞的肿瘤影响不大(图7A-D),但METTL1敲低移植组中的耐药表型被破坏,变现为肿瘤负担(图7A)、肿瘤增长率(图7B)、肿瘤体积(图7C)和肿瘤重量(图7D)的减少。METTL1敲低后,Ki67染色也减少,表明细胞增殖被抑制,同时EGFR的表达也有所下降(图7E-F)。原位杂交小鼠构建后,作者发现METTL1的降低明显恢复了乐伐替尼的治疗效果,肝脏中的肿瘤大小和肿瘤重量减少,同时Ki67和EGFR的表达也下降(图7G-I)。
总而言之,作者表明了靶向METTL1可能有效阻止HCC的乐伐替尼耐药性

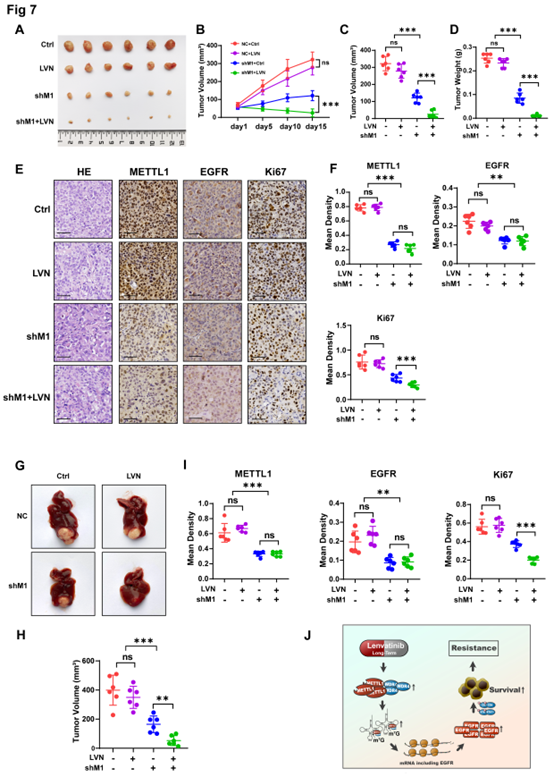
图7 METTL1的敲低可在体内影响乐伐替尼的抗性
在这项研究中,作者通过体外和体内实验,发现了METTL1介导的tRNA m7G修饰通过促进EGFR通路基因的翻译效率诱导HCC细胞乐伐替尼耐药,揭示了HCC乐伐替尼耐药的新机制,并为靶向tRNA甲基化机制来克服HCC中乐伐替尼耐药提供了强有力的科学依据。
往期推荐
客户文章|Food&Function:生态环境对苜蓿多糖结构特性和生物活性的影响
Front Nutr 一作解读|添加天竺葵精油的木薯淀粉复合膜相关性能的研究
一作解读|Foods 火参果 (Cucumis metuliferus) 果皮中果胶的免疫活性和肠道微生物群调节
客户文章|Frontiers in Nutrition.一作解读:甘油和赤藓糖醇不同配比对玉米淀粉基薄膜性能的影响
客户文章|F.C.一作解读:微波加热制备淀粉-脂质复合物的研究
... ...


